
| A、Cl,F | B、Na,F |
| C、Na,Cl | D、Mg,O |


科目:高中化学 来源: 题型:
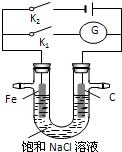
| A、K1闭合,铁棒上发生的反应为2H++2e-→H2↑ |
| B、K1闭合,石墨棒周围溶液pH逐渐升高 |
| C、K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 |
| D、K2闭合,电路中通过0.4NA个电子时,两极共产生标况下4.48L气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuSO4溶液与Ba(OH)2溶液混合:Ba2++SO42-=BaSO4↓ |
| B、澄清石灰水与稀盐酸反应:OH-+H+=H2O |
| C、NaHSO3溶液与NaHSO4溶液混合:SO32-+2H+=H2O+SO2↑ |
| D、铁钉放入硫酸铜溶液中:Fe+3Cu2+=2Fe3++3Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④⑤ | B、②③④ |
| C、③④⑤ | D、②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
| A、+335.7 |
| B、-335.7 |
| C、+16.3 |
| D、-16.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com