
 ,故答案为:
,故答案为: ;
;

科目:高中化学 来源: 题型:
| A、常温常压下,23g的NO2含有的氧原子数为NA |
| B、已知某种元素的一种原子的质量为ag,则该元素的相对原子质量近似为aNA |
| C、某密闭容器盛有0.1molN2和0.4molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
| D、80gNH4NO3晶体中含有NH4+小于NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| A | 单质为密度最小的气体 |
| B | 元素最高正价与最低负价之和为0 |
| D | 可形成D2、D3两种气态单质,其中一单质是保护地球地表环境的重要屏障 |
| E | 存在质量数为23,中子数为12的核素 |
| F | 单质F为淡黄色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
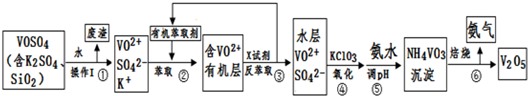
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
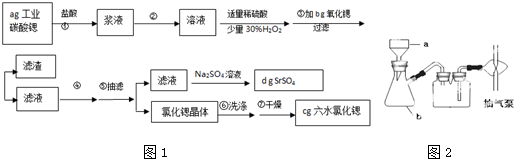
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol/L |
| B、2mol/L |
| C、5mol/L |
| D、3.3mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、22.4 L O2中含有氧分子的个数为2NA |
| B、24g Mg与足量氧气反应转移的电子数为2NA |
| C、28g N2中含有氮原子的个数为NA |
| D、1L 1 mol?L-1MgCl2溶液中含有氯离子个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
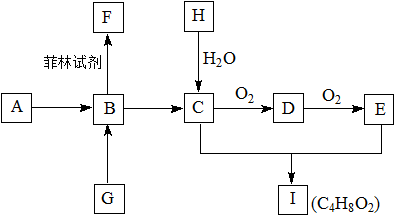
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com