
【题目】溴苯,无色油状液体,具有苯的气味。化工上主要用于溶剂、分析试剂和有机化合成等。某化学小组欲利用如图所示的装罝通过实验探究:
Ⅰ.苯与液溴发生取代反应;

已知:MnO2+2NaBr+2H2SO4![]() Br2↑+MnSO4+Na2SO4+2H2O
Br2↑+MnSO4+Na2SO4+2H2O
(1)仪器X的名称____________________实验室制备溴苯的化学方程式为_____________;这样制取的溴苯可以用 _____________洗涤除Br2。
A.Na2SO3溶液 B.H2O C.乙醇溶液 D.NaOH溶液
(2)制取溴苯的实验操作步骤如下:
①连接装置,其接口顺序为(填字母):d接_________, 接 , 接c
②检查装置的气密性:
③C中加入固体药品,滴加浓硫酸,再打开D处开关K,点燃C处酒精灯;将D装置中的铁丝插入混合液中,一段时间后,D中液体沸腾,原因是 _____________;
④关闭C中分液漏斗的旋塞。
(3)A中对广口瓶进行热水浴的目的__________________。
(4)若B中有淡黄色沉淀生成,能否确定苯与液溴发生了取代反应?________________________(答“能”或“否”)解释其中的原因________________________;
Ⅱ.探究苯与液溴在催化剂作用下的反应机理。
查阅文献:①Br+有强氧化性,可以和水分子发生氧化还原反应②苯与液溴在溴化铁催化下的反应机理共分三步:(填写下列空白)
第一步:Br2+FeBr2![]() Br++FeBr4-
Br++FeBr4-
第二步:Br+ +
请完成第三步反应:____________________________;该小组将A装置中浓硫酸替换成稀硫酸时实验失败,试从反应机理推测可能的原因是__________________________________。
【答案】 球形冷凝管 ![]() AD a,b,e,f 该反应是放热反应。 防止溴单质蒸气冷凝 否 D中会挥发出少量的Br2,Br2也可以和硝酸银产生淡黄色沉淀。 FeBr4-+
AD a,b,e,f 该反应是放热反应。 防止溴单质蒸气冷凝 否 D中会挥发出少量的Br2,Br2也可以和硝酸银产生淡黄色沉淀。 FeBr4-+![]()
![]() FeBr3+
FeBr3+![]() +HBr 有水情况下,无法生成Br+
+HBr 有水情况下,无法生成Br+
【解析】(1)仪器X为球形冷凝管;实验室用苯和溴在催化剂的作用下反应制备溴苯,化学方程式为:![]() ;这样制取的溴苯中往往含有溴单质,除去溴可以用亚硫酸钠溶液将溴还原为易溶于水的盐洗涤除去,也可以选用氢氧化钠与溴反应生成易溶于水的盐除去,溴在水中的溶解度没有在有机溶剂中的溶解度大,不能用水洗的方法除去,故选AD,故答案为:球形冷凝管;
;这样制取的溴苯中往往含有溴单质,除去溴可以用亚硫酸钠溶液将溴还原为易溶于水的盐洗涤除去,也可以选用氢氧化钠与溴反应生成易溶于水的盐除去,溴在水中的溶解度没有在有机溶剂中的溶解度大,不能用水洗的方法除去,故选AD,故答案为:球形冷凝管;![]() ;AD;
;AD;
(2)①溴蒸汽由C制备,由d到a进入热水浴防止冷凝,由c到e进入D中反应,在B中吸收尾气,则顺序为d、a、b、e、f、c;故答案为:a;b;e;f;
③C中加入固体药品,C处滴加浓硫酸,再打开D处开关K,点燃C处酒精灯,制得溴蒸汽反应;该反应是放热反应,插入铁丝于混合液中,一段时间后,D中液体沸腾;故答案为:该反应是放热反应;
(3)为防止Br2蒸气冷凝,A中对广口瓶进行热水浴;故答案为:防止Br2蒸气冷凝;
(4)D中会挥发出少量的Br2,溴蒸汽可与硝酸银反应生成沉淀;故答案为:否;D中会挥发出少量的Br2,Br2也可以和硝酸银产生淡黄色沉淀;
(5)①第三步反应为溴苯的生成,化学反应为: ;故答案为:
;故答案为: ;
;
②将A装置中浓硫酸替换成稀硫酸时实验失败,有水情况下,无法生成Br+;故答案为:有水情况下,无法生成Br+。


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】2005年诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。工业上冶炼钼的化学原理为①2MoS2+7O2![]() 2MoO3+4SO2;②MoO3+2NH3·H2O====(NH4)2MoO4+H2O;③(NH4)2MoO4+2HCl====H2MoO4↓+2NH4Cl;④H2MoO4
2MoO3+4SO2;②MoO3+2NH3·H2O====(NH4)2MoO4+H2O;③(NH4)2MoO4+2HCl====H2MoO4↓+2NH4Cl;④H2MoO4![]() MoO3+H2O;⑤用还原剂将MoO3还原成金属钼。
MoO3+H2O;⑤用还原剂将MoO3还原成金属钼。
则下列说法正确的是
A. MoS2煅烧产生的尾气可直接排空
B. MoO3是金属氧化物,也是碱性氧化物
C. H2MoO4是一种强酸
D. 利用H2、CO和铝分别还原等量的MoO3,所消耗还原剂的物质的量之比为3∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列原子半径的大小顺序正确的是( )
①2s22p2 ②3s23p3 ③2s22p4 ④3s23p2
A. ③>④>②>① B. ④>③>②>①
C. ④>③>①>② D. ④>②>①>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为五种气态烃,其中A、B、C都能使酸性高锰酸钾溶液褪色;1mol C能与2mol Br2完全加成,生成物分子中每个碳原子上有一个溴原子;A与C具有相同的通式;A与H2加成可得B,B与相同条件下N2的密度相同;D是最简单的有机物,E是D的同系物,完全燃烧相同物质的量的B或E生成CO2的量相同。
(1)试确定A、B、C、D、E的结构简式:
A:_____;B:_____;C:_____;D:_____;E:_____。
(2)等质量的A、B、C、D、E完全燃烧,耗氧量最多的是______(填名称,下同)生成二氧化碳最多的是______。
(3)等物质的量的A、B、C、D、E完全燃烧,耗氧量最多的是____(填名称,下同),生成水最多的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁单质及其化合物在生活、生产中有广泛应用。请回答下列问题
(1)氯化铁溶液常用作印刷电路铜板腐蚀剂反应的离子方程式为_______________________。
(2)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2![]() 6SO2+Fe3O4当反应转移16mo1电子,有________mol FeS2参加反应
6SO2+Fe3O4当反应转移16mo1电子,有________mol FeS2参加反应
(3)硫酸铁也可用作絮凝剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是________________________________________________________________。
(4)下表中对陈述I、II的正确性及其有无因果关系的判断都正确的是_______(填字母)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取盐酸与氯化铜的混合溶液27g放入烧杯中,逐滴滴入质量分数为20%的氢氧化钠溶液,产生沉淀质量与滴入氢氧化钠溶液质量关系如图所示。
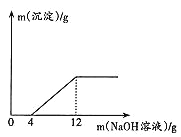
(1)滴入氢氧化钠溶液的质量在0~4g时,发生反应的化学方程式为___________。
(2)与氯化铜反应的氢氧化钠的质量为____________g。
(3)求原盐酸与氯化铜的混合溶液中氯化铜的质量分数______(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 136g熔融的KHSO4中含有2NA个阳离子
B. 40gH218O与40gD2O所含的中子数均为20NA
C. 1molFe分别与足量的稀硫酸和稀硝酸反应转移电子数均为2NA
D. 标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(能力挑战题)已知五种元素的原子序数的大小顺序为C>A>B>D>E;A、C同周期,B、C同主族;A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30,D和E可形成4核10个电子分子。试回答下列问题:
(1)写出五种元素的名称。
A ,B ,C ,D ,E 。
(2)用电子式表示离子化合物A2B的形成过程:_________ ____________。
(3)写出D元素形成的单质的结构式: ____________________。
(4)写出下列物质的电子式:
E与B形成的化合物: ;A、B、E形成的化合物: ;D、E形成的化合物: ___________。
(5)A、B两元素组成的化合物A2B2属于 (填“离子”或“共价”)化合物,存在的化学键是 ,写出A2B2与水反应的化学方程式___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com