
【题目】一种钌(Ru)基配合物光敏染料敏化太阳能电池,其原理如图所示。下列说法错误的是

A. 电池工作时,光能转变为电能,X为电池的负极
B. 电池工作时,电解质溶液中I-和I3-的浓度基本不变
C. 镀铂导电玻璃上发生氧化反应生成I-
D. 电解质溶液中发生反应:2Ru3++3I![]() 2Ru2++I3-
2Ru2++I3-
【答案】C
【解析】
根据图像分析,工作时,电子从电极X流出,为负极,经外电路到电极Y,Y为正极。
A. 根据图像分析,工作时,电子从电极X流出,为负极。整个电池就是将太阳能转化为电能,A项不符合题意;
B.电池工作时,I3-转化为I-,I-又会转化为I3-,形成一个回路,因此I-和I3-的浓度基本不变,B项不符合题意;
C.镀铂导电玻璃上发生的反应为I3-转化为I-,碘的化合价从-1/3降低为-1,得到电子,发生还原反应,C项符合题意;
D.在电解质溶液中Ru(Ⅲ)转化为Ru(Ⅱ),同时I-转化为I3-,则根据电荷守恒,可知道2Ru3++3I-![]() 2Ru2++I3-,D项不符合题意;
2Ru2++I3-,D项不符合题意;
本题答案选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 甲醇燃料电池工作时,甲醇得到电子,发生还原反应
B. 室温下,稀释0.1 mol·L-1氨水,c(H+)·c(NH3·H2O)的值减小
C. 将1 mol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为2×6.02×1023
D. SiO2(s)+2C(s)===Si(s)+2CO(g)在常温下不能自发进行,则该反应的ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁(简称PFS或聚铁)是水处理中重要的絮凝剂。以黄铁矿的烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制取聚合硫酸铁(![]() )的工艺流程如下:
)的工艺流程如下:
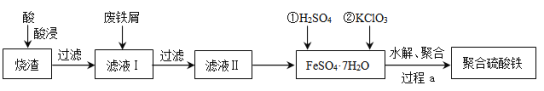
(1)酸浸时最合适的酸是_____(写化学式)。
(2)酸浸后溶液中主要的阳离子有_____。
(3)加入KClO3的目的是_____________________________(结合离子方程式说明)。
(4)过程a中生成聚合硫酸铁的过程是先水解再聚合。将下列水解反应原理的化学方程式补充完整。
_____Fe2(SO4)3+_____H2O![]() ______Fe2(OH)x(SO4)3-
______Fe2(OH)x(SO4)3-![]() + _____ ______
+ _____ ______
(5)过程a中水解要严控pH的范围。pH偏小或偏大聚合硫酸铁的产率都会降低,请解释原因__________。
(6)盐基度B是衡量絮凝剂絮凝效果的重要指标,通常盐基度越高,絮凝效果越好。盐基度B的表达式:![]() (n为物质的量)。为测量聚合硫酸铁的盐基度,进行如下实验操作:
(n为物质的量)。为测量聚合硫酸铁的盐基度,进行如下实验操作:
ⅰ.取聚合硫酸铁样品m g,加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,再加入KF溶液屏蔽Fe3+,使Fe3+不与OH-反应。然后以酚酞为指示剂,用c mol/L的标准NaOH溶液进行中和滴定,到终点时消耗NaOH溶液V mL。
ⅱ.做空白对照实验,取与步骤ⅰ等体积等浓度的盐酸,以酚酞为指示剂,用c mol/L的标准NaOH溶液进行中和滴定,到终点时消耗NaOH溶液V0 mL。
①该聚合硫酸铁样品中n(OH-) =_________mol。
②已知该样品中Fe的质量分数w,则盐基度B=_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列事实不能说明NH3H2O为弱电解质的是
A. 0.1 molL-1 NH3H2O溶液的pH小于13
B. Al(OH)3在浓氨水中不能溶解
C. 相同条件下,浓度均为0.1 molL-1的NaOH溶液和氨水,氨水的导电能力弱
D. 向0.1 molL-1 NH3H2O溶液中加入MgCl2溶液产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列各有机物的结构简式:
(1)当0.2 mol烃A在氧气中完全燃烧生成CO2和H2O各1.2 mol,催化加成后生成2,2二甲基丁烷,则A的结构简式为__________________________________。
(2)某炔烃与H2充分加成生成2,5-二甲基己烷,该炔烃的结构简式为________________________。
(3)某气态烃100 mL(标准状况)与含1.43 g溴的溴水恰好完全加成,生成物经测定每个碳原子上都有一个溴原子,该烃的结构简式为__________________________________。
(4)某烃1 mol与2 mol HCl完全加成,生成的氯代烃最多还可以与4 mol Cl2反应,则该烃的结构简式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能证明甲酸(HCOOH,一元酸)为弱酸的是( )
A.0.1mol/L甲酸的pH为2.3
B.将pH=2的甲酸稀释100倍后,溶液的pH小于4
C.温度升高,溶液的导电能力增强
D.等体积等浓度的甲酸和HCl与足量的锌反应,产生等量的氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中发生如下反应:X(g)+3Y(g)![]() 2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是

A. t2时加入了催化剂 B. t3时降低了温度
C. t5时增大了压强 D. t4~t5时间内转化率一定最低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在盛有足量A的体积可变的密闭容器中,加入B,发生反应:A(s)+2B(g)![]() 4C(g)+D(g)ΔH<0。在一定温度、压强下达到平衡。平衡时C的物质的量与加入的B的物质的量的变化关系如图。下列说法正确的是
4C(g)+D(g)ΔH<0。在一定温度、压强下达到平衡。平衡时C的物质的量与加入的B的物质的量的变化关系如图。下列说法正确的是

A. 当温度升高后,则图中θ>45°
B. 若再加入B,再次达到平衡状态时,正、逆反应速率均增大
C. 平衡时B的转化率为50%
D. 若再加入B,则平衡后反应体系气体密度减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com