
【题目】下列化学用语正确的是 ( )
A. NaHCO3的水解:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. CaCO3的电离:CaCO3![]() Ca2++CO32-
Ca2++CO32-
C. 碳酸钙的溶解平衡:CaCO3(s)![]() Ca2+(aq)+CO32-(aq)
Ca2+(aq)+CO32-(aq)
D. Na2S溶液的水解:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
科目:高中化学 来源: 题型:
【题目】高锰酸钾常用作消毒剂、水质净化剂等。工业上用软锰矿(主要含MnO2,还含有少量SiO2、Al2O3、Fe2O3等杂质)制备高锰酸钾晶体的一种工艺流程如下:
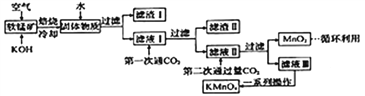
回答下列问题:
(1)焙烧过程中发生的主要反应为MnO2+KOH+O2![]() K2MnO4+H2O,该反应配平后MnO2与O2的系数比为________。采用对空气加压的方法可提高MnO2的利用率。原因是__________________________。
K2MnO4+H2O,该反应配平后MnO2与O2的系数比为________。采用对空气加压的方法可提高MnO2的利用率。原因是__________________________。
(2)滤渣Ⅱ是________,第一次通CO2不能用稀盐酸代替的原因是____________________________。
(3)第二次通入过量CO2生成MnO2的离子方程式为__________________________。
(4)由下图可知,从滤液Ⅲ得到高锰酸钾晶体需经过________、________、洗涤等一系列操作。
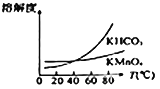
(5)1t含MnO287%的软锰矿,理论上最多可制得________tKMnO4晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用乙烯和乙醇为原料制取草酸二乙酯的过程中发生的反应类型及顺序正确的是
①酯化反应 ②氧化反应 ③水解反应 ④加成反应
A. ②④③① B. ④①②③ C. ④③②① D. ②③①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 常温下,将3种一元酸分别和NaOH溶液等体积混合,实验数据如下:
组别 | c(一元酸)或c(H+) | c(NaOH)/mol/L | 混合溶液的pH |
甲 | c(H+)=0.1 mol/L的HX酸 | 0.1 | pH=a |
乙 | c(HY)=0.1mol/L | 0.1 | pH=7 |
丙 | c(HZ)=0.1 mol/L | 0.1 | pH=9 |
(1)甲组实验中HX为弱酸,a______7(填“<”,“=”或“>”)。
(2)乙组实验中HY溶液的pH=______。
(3)丙组实验发生反应的离子方程式为__________________,
所得溶液中由水电离出的c(OH-)=______mol/L。
II. 将0.1 mol·L-1 NaOH溶液分别滴入体积均为20 mL、浓度均为0.1 mol·L-1 HCl溶液和HA溶液,溶液的pH随加入NaOH溶液体积变化如图:
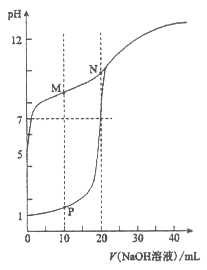
(1)HA为_______酸(填“强”或“弱”)。
(2)N点pH>7的原因是(用离子方程式表示)_________。
(3)下列说法正确的是_______ (填字母)。
a. M点c(HA)-)
b. M点c(Na+)>c(OH-)
c. P点c(Cl-)=0.05 mol·L-1
(4)NaA与NaOH等浓度等体积混合时,溶液中c(A-)______c(OH-)(填“<”,“=”或“>”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发展洁净煤技术、利用CO2制备清洁能源等都是实现减碳排放的重要途径。
(1)将煤转化成水煤气的反应:C(s)+H2O(g)![]() CO(g)+H2(g)可有效提高能源利用率,若在上述反应体系中增大H2的浓度(其他条件保持不变),此反应的△H_____(填“增大”、“减小”或“不变”)。
CO(g)+H2(g)可有效提高能源利用率,若在上述反应体系中增大H2的浓度(其他条件保持不变),此反应的△H_____(填“增大”、“减小”或“不变”)。
(2)CO2制备甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=-49.0 kJ·mol-1,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2(g)和CH3OH(g)浓度随时间变化如图所示。
CH3OH(g)+H2O(g)△H=-49.0 kJ·mol-1,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2(g)和CH3OH(g)浓度随时间变化如图所示。

①该反应化学平衡常数K的表达式是_________。
②0~9 min时间内,该反应的平均反应速率v(H2)=_________。
③在相同条件下,密闭容器的体积缩小至0.5 L时,此反应达平衡时放出的热量(Q)可能是_________(填字母序号)kJ。
a. 0<Q<29.5 b. 29.5<Q<36.75
c. 36.75<Q<49 d. 49<Q<98
④在一定条件下,体系中CO2的平衡转化率(![]() )与L和X的关系如图所示,L和X分别表示温度或压强。
)与L和X的关系如图所示,L和X分别表示温度或压强。

i. X表示的物理量是_________。
ii. 判断L1与L2的大小关系:L1________L2(填“<”,“=”或“>”),并简述理由:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是资源的宝库,海水淡化可获得淡水和浓海水。浓海水中主要含有的离子有Na+、 Mg2+ 、Cl﹣、SO42﹣。从浓海水中提取金属镁的一段工艺流程如图所示:
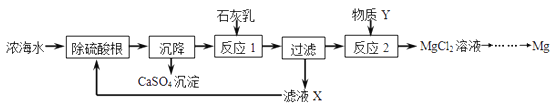
(1)写出反应2的化学方程式:_________________________________________。
(2)操作流程中可循环使用的物质是___________(填化学式)。
(3)在实验室如何证明溶液中的SO42﹣已完全沉淀:_____________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【题目】下列描述中正确的是 ( )
A. 纯碱溶于热水后去污效果增强,说明纯碱的水解反应是吸热反应
B. NH3(g) + HCl(g) = NH4Cl(s) 在较低温度下能自发进行,说明该反应的ΔH>0
C. 500℃、30 MPa下,将7 g N2和3 g H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
D. 甲烷的燃烧热(ΔH)为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)= CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐是一类常见的物质,下列物质可直接反应生成盐的是( )
①金属 ②非金属 ③酸 ④碱 ⑤酸性氧化物 ⑥碱性氧化物.
A.只有③④
B.只有①②
C.只有①③⑤
D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应: 3A(g)+B(g) ![]() 3C(g)+2D(g),经5 min后,测得D的浓度为0.5mol/L,n(A)∶n(B)=3∶5。求:
3C(g)+2D(g),经5 min后,测得D的浓度为0.5mol/L,n(A)∶n(B)=3∶5。求:
(1)此时A的浓度c(A)=_________mol/L,
(2)反应开始前容器中的A、B的物质的量:n(A)=n(B)=________ mol。
(3)B的平均反应速率:v(B)=__________mol/(L·min)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com