
| A、P4和NO2都是共价化合物 |
| B、CCl4和NH3都是以极性键结合的极性分子 |
| C、在CaO和SiO2晶体中,都不存在单个小分子 |
D、 铜晶体的晶胞结构如图所示,该晶胞实际拥有7个铜原子 |
| 1 |
| 8 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、产物B的状态只能为固态或液态 |
| B、平衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1 |
| C、若开始时向容器中加入1molB和1molC,达到平衡时放出热量QkJ |
| D、保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、改用浓硫酸 |
| B、加入少量硫酸铜溶液 |
| C、加入氢氧化钠溶液 |
| D、加入醋酸钠固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石油的裂解可以提高汽油的产量和质量 |
| B、某有机物在空气中完全燃烧只生成二氧化碳和水,则此有机物一定含有碳、氢、氧三种元素 |
| C、石油分馏出来的各馏分仍是多种烃的混合物 |
| D、乙烯能使溴水及酸性高锰酸钾溶液褪色,原因是相同的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升温 | B、增大反应器的体积 |
| C、增大c(A) | D、降温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KHC2O4溶液中:c(C2O42-)<c(H2C2O4) |
| B、当滴定至中性时:c(C2O42-)═c(Na+)+c(H2C2O4) |
| C、滴入20mL 0.1 mol?L-1NaOH溶液时,溶液中:c(Na+)═c(K+)=2c(C2O42-) |
| D、滴定过程中:c(H+)+c(Na+)+c(K+)═c(OH-)+c(HC2O4-)+c(C2O42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
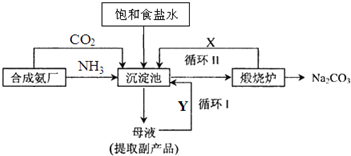
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com