
| A、KHC2O4溶液中:c(C2O42-)<c(H2C2O4) |
| B、当滴定至中性时:c(C2O42-)═c(Na+)+c(H2C2O4) |
| C、滴入20mL 0.1 mol?L-1NaOH溶液时,溶液中:c(Na+)═c(K+)=2c(C2O42-) |
| D、滴定过程中:c(H+)+c(Na+)+c(K+)═c(OH-)+c(HC2O4-)+c(C2O42-) |


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
A、Cu
| ||||||
B、Cu
| ||||||
C、Cu
| ||||||
D、Cu
|
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CH4+2O2
| |||
B、ClCH2CH3+NaOH
| |||
C、CH3CH═CH2+Cl2
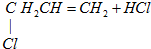 | |||
D、CH2═CH2+HCl
|
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 该图表示25℃时,用0.1mol?L-1盐酸滴定20mL0.1mol?L-1NaOH溶液,溶液的pH随加入酸体积的变化 |
B、 该图中曲线表示反应2SO2(g)+O2(g)?2SO3(g)△H<0正、逆反应的平衡常数 |
C、 图表示10mL0.01mol?L-1KMnO4酸性溶液与过量的0.1mol?L-1草酸溶液混合 |
D、 图中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH2(g)△H<0使用和未使用催化剂时,反应过程中的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、P4和NO2都是共价化合物 |
| B、CCl4和NH3都是以极性键结合的极性分子 |
| C、在CaO和SiO2晶体中,都不存在单个小分子 |
D、 铜晶体的晶胞结构如图所示,该晶胞实际拥有7个铜原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4Cl溶液中NH4+和Cl-数目 | ||
| B、纯水在100℃和25℃时的pH | ||
| C、完全中和相同pH且相同体积的氨水和NaOH溶液,所需的0.1mol?L-1盐酸体积 | ||
D、CH3COONa溶液加水稀释前后的
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| Ksp[Mg(OH)2] | Ksp[Fe(OH)3] | 氨气的饱和溶液 |
| 1.8×10-11 | 4.0×10-38 | c(OH-)=1×10-3mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com