
【题目】V2O5可作化学工业中的催化剂,广泛用于冶金、化工等行业。V2O5是一种橙黄色片状晶体,微溶于水,具有强氧化性,属于两性氧化物。某研究小组将从钒铅锌矿(主要含有V2O5、PbO、ZnO、CaO)中提取V2O5及回收铅、锌等金属。工艺流程如下图所示:
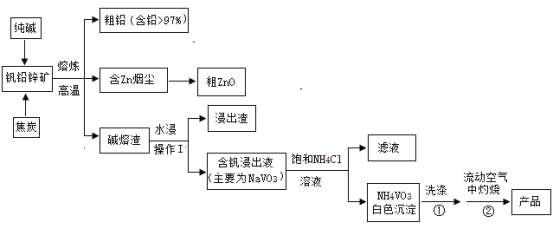
已知:NH4VO3是白色粉末,可溶于热水,微溶于冷水,不溶于乙醇、乙醚。2NH4VO3![]() V2O5+2NH3↑+H2O
V2O5+2NH3↑+H2O
请回答:
(1)钒铅锌矿高温熔炼时,生成金属铅的反应属于基本反应类型中的________反应; V2O5与纯碱反应的化学方程式为_______________________。
(2)流程中操作I的名称是_______________________。
(3)焦炭用量对还原熔炼效果的影响如下左图所示。分析图像可知,焦炭用量应取矿石质量的约______% 较为合适。

(4)钒浸出过程中,液固比(液体质量:固体质量)对钒浸出率的影响如上右图所示。分析图像可知,浸出过程的液固比最合适的比例约为2:1,理由是___________。
(5)为制取纯度较高的V2O5,往含钒浸出液(主要为NaVO3)中加NH4Cl溶液,该反应的化学方程式是_________________________。
(6)在洗涤①操作时,可选用的洗涤剂________ (填选项字母)。
A.乙醚 B.1% NH4Cl 溶液 C.热水 D.冷水
(7)在灼烧②操作时,需在流动空气中灼烧的可能原因_____________________。
【答案】置换 V2O5+Na2CO3![]() 2NaVO3+ CO2↑ 过滤 10 液固比为2:1时,钒浸出率在97%以上,再进一步增大液固比,钒浸出率提高不明显,而且还会导致浸出用水量、废水排放量的增大。 NaVO3+NH4Cl=NaCl+NH4VO3↓ BD 若空气不流通,由于V2O5具有强氧化性,会与还原性的NH3反应,从而影响产物的纯度及产率
2NaVO3+ CO2↑ 过滤 10 液固比为2:1时,钒浸出率在97%以上,再进一步增大液固比,钒浸出率提高不明显,而且还会导致浸出用水量、废水排放量的增大。 NaVO3+NH4Cl=NaCl+NH4VO3↓ BD 若空气不流通,由于V2O5具有强氧化性,会与还原性的NH3反应,从而影响产物的纯度及产率
【解析】
(1)反应过程中加入了单质碳,反应生成单质金属铅,反应属于基本反应类型中的置换反应。V2O5与纯碱反应生成NaVO3和 CO2气体,故反应方程式为V2O5+Na2CO3![]() 2NaVO3+ CO2↑ 。
2NaVO3+ CO2↑ 。
故答案为 置换 V2O5+Na2CO3![]() 2NaVO3+ CO2↑
2NaVO3+ CO2↑
(2)流程中操作I是分离难溶性固体与可溶性液体混合物,名称是过滤。
故答案为 过滤
(3)根据焦炭用量对还原熔炼效果的影响图像可知,焦炭用量应取矿石质量的约10%较为合适。
故答案为 10
(4)钒浸出过程中,液固比(液体质量:固体质量)对钒浸出率的影响如上右图所示。分析图像可知,浸出过程的液固比最合适的比例约为2:1,这时浸出率为97%以上,为进一步增大液固比,钒浸出率提高不明显,而且还会导致浸出用水量、废水排放量增大等问题;
故答案为 液固比为2:1时,钒浸出率在97%以上,再进一步增大液固比,钒浸出率提高不明显,而且还会导致浸出用水量、废水排放量的增大。
(5)往含钒浸出液中加NH4Cl溶液,发生反应NaVO3+NH4Cl=NaCl+NH4VO3↓,该反应属于基本反应类型中的复分解反应。
故答案为 NaVO3+NH4Cl=NaCl+NH4VO3↓
(6)已知NH4VO3可溶于热水,微溶于冷水,不溶于乙醇、乙醚。且为减小产物的损失,可以选择1% NH4Cl 溶液和冷水进行洗涤。
故答案为 BD
(7)灼烧操作②的过程中由NH4VO3灼烧得到V2O5和NH3↑,若空气不流通,由于V2O5具有强氧化性,会与还原性的NH3反应,从而影响产物的纯度及产率,故要在流通的热空气中进行。
故答案为若空气不流通,由于V2O5具有强氧化性,会与还原性的NH3反应,从而影响产物的纯度及产率。


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】下表中有关变化和反应的对应关系正确的是( )
A | 蒸馏;干馏 | 均为物理变化 |
B | 2FeCl3+Cu=2FeCl2+CuCl2; SiO2+2C | 均为置换反应 |
C | Cl2通入品红溶液中,品红褪色;木炭加入品红溶液中,振荡,褪色 | 前者为化学变化,后者为物理变化 |
D | 在沸水中滴加饱和FeCl3溶液;在CuCl2溶液中滴加NaOH溶液 | 均为生成沉淀的复分解反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的元素定量分析最早是由德国人李比希提出的,某实验室模拟李比希法测定某种氨基酸(CxHyOzNp)的分子组成。取一定量的该氨基酸放在纯氧气中燃烧,燃烧后生成的水用装置D(无水氯化钙)吸收,二氧化碳用装置C(KOH浓溶液)吸收,N2的体积用E装置进行测量,所需装置如下图(夹持仪器的装置及部分加热装置已略去):

(1)该实验装置的合理连接顺序为:A、__、E。(部分装置可以重复选用)
(2)实验开始时,首先打开止水夹a,关闭止水夹b,通一段时间的纯氧,这样做的目的是_____。
(3)A中放入CuO的作用是_______,装置B的作用是_____。
(4)为了确定此氨基酸的分子式,除了准确测量N2的体积、生成二氧化碳和水的质量外,还需得到的数据有___。
(5)在读取E装置中所排水的体积时,液面左低右高,则所测气体的体积____(填“偏大”、“偏小”或“无影响”)。
(6)已知分子式为C2H4O2的有机物也含有氨基酸中的某个官能团,请设计实验证明该官能团(试剂任选):____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有短周期主族元素X、Y、Z、R、T,R原子最外层电子数是电子层数的2倍,Z是金属元素,Y与Z能形成Z2Y、Z2Y2型化合物,Z与T形成化学式为Z2T的化合物,五种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )
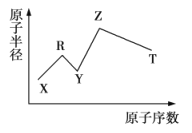
A.原子半径和离子半径均满足:![]()
B.最高价氧化物对应的水化物的酸性:![]()
C.简单氢化物的稳定性:![]()
D.由X、Y、Z、T四种元素组成的化合物的水溶液一定呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分短周期元素原子半径与原子序数的关系如图所示.则下列说法正确的是( )
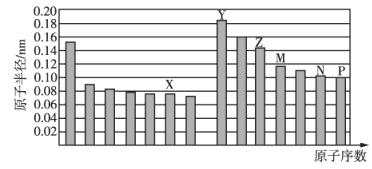
A.简单离子半径:![]()
B.简单氢化物的稳定性:![]()
C.由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D.Z的氧化物既能溶解于Y的最高价氧化物对应水化物的水溶液中,也能溶解于P的氢化物的水溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】简单原子的原子结构可用下图形象地表示:
![]()
其中“●”表示质子或电子,“○”表示中子,则下列有关①②③的叙述正确的是( )
A. ①②③是三种不同的氢分子B. ①②③互为同位素
C. ①②③是三种化学性质不同的粒子D. ①②③具有相同的质量数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g) ΔH ]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。我国科学家在这一变换中利用双功能催化剂突破了低温下高转化率与高反应速率不能兼得的难题。反应历程如图所示:
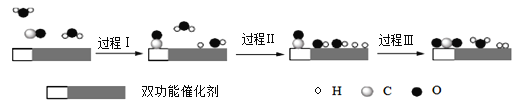
下列说法正确的是
A.低温下实现高反应速率是因为使用了双功能催化剂降低了水煤气变换反应的ΔH
B.过程Ⅰ为吸热过程、过程Ⅲ为放热过程
C.过程Ⅲ生成了具有非极性共价键的H2、CO2
D.图示中的2个H2O分子只有一个H2O分子参与了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.CH3COOCH2CH3 与CH3CH2COOCH3 中均含有甲基、乙基和酯基,为同一种物质
B.![]() 和
和 ![]() 为同一物质
为同一物质
C.CH3CH2CH2CH2CH3 和CH3CH2CH(CH3)2 互为同素异形体
D.CH3CH2OH 和 CH2OHCHOHCH2OH 具有相同的官能团,互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性
Ⅰ.实验室制备FeBr2
实验室用下图所示装置制取溴化亚铁.其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管,e是两个耐高温的瓷皿,其中盛有细铁粉。
实验开始时先将铁粉加热至600℃~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,不断将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁。
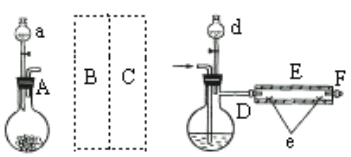
请回答:
(1)若在A中盛固体CaCO3,a中盛6mol/L盐酸,B处是装有饱和NaHCO3溶液的洗气瓶为使导入D中的CO2为干燥纯净的气体,则图中C处的装置和其中的试剂应是:________,为防止污染空气,实验时应在F处连接盛________的尾气吸收装置。
(2)反应过程中要不断通入CO2,其主要作用有两个:①是利用CO2把反应器中空气赶尽;②是________.
Ⅱ.探究FeBr2的还原性
(1)实验需要90 mL 0.1 mol·L-1FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外还需的玻璃仪器是________。
(2)取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
设计实验证明假设2是正确的_______________________________
(3)实验证明:还原性Fe2+>Br-请用一个离子方程式来证明:_____________;
(4)若在40mL上述FeBr2溶液中通入3×10-3molCl2,则反应的离子方程式为:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com