
【题目】下表中有关变化和反应的对应关系正确的是( )
A | 蒸馏;干馏 | 均为物理变化 |
B | 2FeCl3+Cu=2FeCl2+CuCl2; SiO2+2C | 均为置换反应 |
C | Cl2通入品红溶液中,品红褪色;木炭加入品红溶液中,振荡,褪色 | 前者为化学变化,后者为物理变化 |
D | 在沸水中滴加饱和FeCl3溶液;在CuCl2溶液中滴加NaOH溶液 | 均为生成沉淀的复分解反应 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】H2O2广泛应用于医疗卫生、化学合成等领域。
(1)H2O2的电子式是___________。
(2)趣味实验“大象牙膏”的实验原理是H2O2溶液在KI催化作用下分解,反应的机理可表示为:i.H2O2(l)+I-(aq)==== H2O(l)+IO-(aq) △H1 = +a kJ/moL(a > 0)
ii.H2O2(l)+________________________________。
① 2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ/mol,补全反应ii_______________(用热化学方程式表示)。
② 某小组在研究影响H2O2分解速率的因素时得到图1的数据关系,由此得出的结论是________。
③ 已知:i的反应速率小于ii的反应速率,在图2画出H2O2溶液中加入KI后,“反应过程—能量”示意图。_________

(3)为分析不同试剂是否对H2O2分解有催化作用,该小组向四支盛有10mL5% H2O2的试管中滴加不同溶液,实验记录如下:
试管 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
滴加试剂 | 2滴1mol/L NaCl | 2滴1mol/L CuSO4 | 2滴1mol/L CuSO4 和2滴1mol/L NaCl | 2滴1mol/L CuSO4 和4滴1mol/L NaCl |
产生气泡情况 | 无气泡产生 | 均产生气泡,且气泡速率从Ⅱ到Ⅳ依次加快 | ||
实验Ⅰ的目的是______________,由实验(3)可得出的结论是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向MgCl2、AlCl3的混合溶液中,开始滴加试剂X,之后改滴试剂Y,所得沉淀的物质的量n(mol)与试剂体积V(mL)间的关系如图所示。以下结论错误的是( )
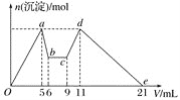
A.X是盐酸,Y是NaOH溶液,且c(Y)=2c(X)
B.原混合液中,c(Al3+)∶c(Mg2+)∶c(Cl-)=1∶1∶5
C.X是NaOH溶液,Y是盐酸,且c(NaOH)∶c(HCl)=2∶1
D.从b至c相应的离子方程式为H++OH-===H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列原子或原子团,请按要求选择两个,写出符合要求的有机物的结构简式:﹣CH3、﹣OH、﹣CHO、﹣COOH、﹣Br、﹣H、﹣CH2CH3、![]()
(l)分子结构为正四面体的是:___;
(2)能使FeCl3溶液显紫色的是:___;
(3)在NaOH乙醇溶液中能发生消去反应的是:____;
(4)1mol该有机物与足量的银氨溶液反应,有4molAg生成的是:___;
(5)相对分子质量是60,能和NaHCO3反应放出CO2的是:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把2.0mol/LCuSO4溶液和1.0mol/L H2SO4溶液等体积混合(假设混合后溶液的体积等于混合前两种溶液的体积之和)。则:混合液中CuSO4的物质的量浓度___。H2SO4的物质的量浓度___。混合液中c(H+)___、c(Cu2+)___、c(SO42-)___。向溶液中加入足量铁粉,经过足够长的时间后,铁粉有剩余。此时溶液中Fe2+的物质的量浓度为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在催化剂作用下,用乙醇制乙烯,乙醇转化率和乙烯选择性(生成乙烯的物质的量与乙醇转化的物质的量的比值)随温度、乙醇进料量(单位:mL·min-1)的关系如图所示(保持其他条件相同)。

在410~440℃温度范围内,下列说法不正确的是
A. 温度一定时,随乙醇进料量增大,乙醇转化率减小
B. 温度一定时,随乙醇进料量增大,乙烯选择性增大
C. 乙醇进料量一定时,随温度的升高,乙烯选择性一定增大
D. 选择适当的催化剂在一定条件下,可大幅提高乙烯在最终产物中的比率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,甘氨酸在水溶液中解离情况如下:H3N+CH2COOH(A+)![]() H3N+CH2COO-(A±)
H3N+CH2COO-(A±)![]() H2NCH2COO-(A-),改变溶液pH值,三种甘氨酸相关离子的分布分数(α,平衡时某物种的浓度占各物种浓度之和的分数)变化如图所示。当调节溶液的pH值使甘氨酸所带的净电荷为零,此时溶液的pH叫等电点。下列说法正确的是( )
H2NCH2COO-(A-),改变溶液pH值,三种甘氨酸相关离子的分布分数(α,平衡时某物种的浓度占各物种浓度之和的分数)变化如图所示。当调节溶液的pH值使甘氨酸所带的净电荷为零,此时溶液的pH叫等电点。下列说法正确的是( )
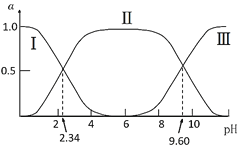
A.曲线Ⅰ、Ⅱ、Ⅲ分别代表的微粒为A、A±、A+
B.K2=102.34,且K2对应的解离基团为-NH3+
C.在pH=9.60的溶液中加盐酸,α(A±)+α(A+)+α(A)保持不变
D.甘氨酸的等电点pH约为6,且存在c(A±)=c(A+)=c(A)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在水溶液中1mol Cl-、![]() (x=1、2、3、4)的能量(kJ)相对大小如图所示。下列有关说法中正确的是( )
(x=1、2、3、4)的能量(kJ)相对大小如图所示。下列有关说法中正确的是( )
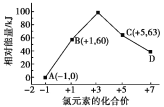
A.D是![]()
B.B→A+C反应的活化能为60kJ·mol-1
C.A、B、C、D中C最稳定
D.B→A+C反应的热化学方程式:3ClO-(aq)=![]() (aq)+2Cl-(aq) ΔH= -117kJ·mol-1
(aq)+2Cl-(aq) ΔH= -117kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】V2O5可作化学工业中的催化剂,广泛用于冶金、化工等行业。V2O5是一种橙黄色片状晶体,微溶于水,具有强氧化性,属于两性氧化物。某研究小组将从钒铅锌矿(主要含有V2O5、PbO、ZnO、CaO)中提取V2O5及回收铅、锌等金属。工艺流程如下图所示:
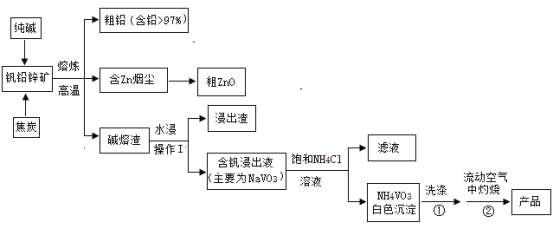
已知:NH4VO3是白色粉末,可溶于热水,微溶于冷水,不溶于乙醇、乙醚。2NH4VO3![]() V2O5+2NH3↑+H2O
V2O5+2NH3↑+H2O
请回答:
(1)钒铅锌矿高温熔炼时,生成金属铅的反应属于基本反应类型中的________反应; V2O5与纯碱反应的化学方程式为_______________________。
(2)流程中操作I的名称是_______________________。
(3)焦炭用量对还原熔炼效果的影响如下左图所示。分析图像可知,焦炭用量应取矿石质量的约______% 较为合适。

(4)钒浸出过程中,液固比(液体质量:固体质量)对钒浸出率的影响如上右图所示。分析图像可知,浸出过程的液固比最合适的比例约为2:1,理由是___________。
(5)为制取纯度较高的V2O5,往含钒浸出液(主要为NaVO3)中加NH4Cl溶液,该反应的化学方程式是_________________________。
(6)在洗涤①操作时,可选用的洗涤剂________ (填选项字母)。
A.乙醚 B.1% NH4Cl 溶液 C.热水 D.冷水
(7)在灼烧②操作时,需在流动空气中灼烧的可能原因_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com