
【题目】现有短周期主族元素X、Y、Z、R、T,R原子最外层电子数是电子层数的2倍,Z是金属元素,Y与Z能形成Z2Y、Z2Y2型化合物,Z与T形成化学式为Z2T的化合物,五种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )
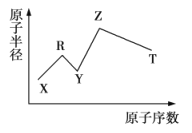
A.原子半径和离子半径均满足:![]()
B.最高价氧化物对应的水化物的酸性:![]()
C.简单氢化物的稳定性:![]()
D.由X、Y、Z、T四种元素组成的化合物的水溶液一定呈中性
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】四氢铝锂(LiAlH4)常作有机合成的重要还原剂。以辉锂矿(主要成分是Li2O·Al2O3·4SiO2,含少量Fe2O3)为原料合成四氢铝锂的流程如下:
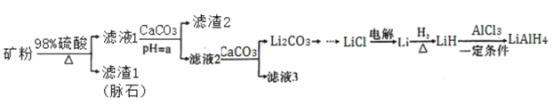
已知:①几种金属氢氧化物沉淀的pH如表所示:
物质 | Fe(OH)3 | Al(OH)3 |
开始沉淀的pH | 2.3 | 4.0 |
完全沉淀的pH | 3.7 | 6.5 |
②常温下,Ksp(Li2CO3)=2.0×10-3,Li2CO3在水中溶解度随着温度升高而减小。
回答下列问题:
(1)上述流程中,提高“酸浸”速率的措施有________________、加热;加入CaCO3的作用是_____,“a”的最小值为______________。
(2)写出LiH和AlC13反应的化学方程式为_____________(条件不作要求)。
(3)用热水洗涤Li2CO3固体,而不用冷水洗涤,其目的是_______________。
(4)四氢铝锂LiAlH4溶解于NaOH溶液后得到无色透明溶液,并产生一种无色气体。请写出该反应的离子方程式_____________________。
(5)在有机合成中,还原剂的还原能力通常用“有效氢”表示,其含义是1克还原剂相当于多少克氢气的还原能力。LiAlH4的“有效氢”为________________(结果保留2位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗菌作用的白头翁素衍生物H的合成路线如下图所示:
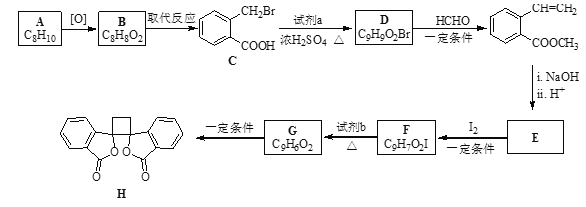
已知:i.RCH2Br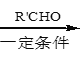 R-HC=CH-R’
R-HC=CH-R’
ii. R-HC=CH-R’ 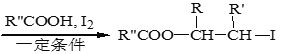
iii. R-HC=CH-R’ 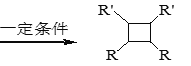
(以上R、R’、R’’代表氢、烷基或芳基等)
(1)A属于芳香烃,其名称是_________
(2)B的结构简式是__________。
(3)由C生成D的化学方程式是__________。
(4)由E与I2在一定条件下反应生成F的化学方程式是___________。
(5)以乙烯为起始原料,结合已知信息选用必要的无机试剂合成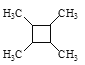 ,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。______
,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在A~I的元素中选择符合题意的元素,按要求回答下列问题:
族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | D | E | G | |||||
3 | B | C | J | F | H | I |
(1)只有负价而无正价的是______(填元素名称);
(2)最高价氧化物的水化物酸性最强的是____(填化学式);
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的化合物的结构式 _____;
(4)在B、C、D、J、 E、F、G、H中,原子半径最大的是____(填原子符号);
(5)画出上述元素中金属性最强的元素的原子结构示意图______;
(6)C单质与氢氧化钠溶液反应的离子方程式________________________;
(7)用电子式表示E单质的形成过程_______________________
(8)写出冶炼B单质的化学方程式____________________;
(9)D的最简单氢化物的燃烧热为890.3 kJ/mol,写出D的最简单氢化物燃烧热的热化学方程式_____;
(10)写出NaHSO4熔融时电离方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,M、N两种气体的物质的量随时间变化的曲线如图所示:
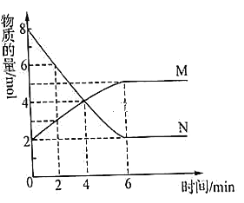
(1)反应的化学方程式为__。
(2)反应达到最大限度时,反应速率v(N)=__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在体积均为20mL、浓度均为0.1mol·L-1的HX溶液、HY溶液中分别滴加同浓度的NaOH溶液,反应后溶液中水电离的c(H+)表示为pH水=-lgc(H+)水。pH水与滴加氢氧化钠溶液体积的关系如图所示。
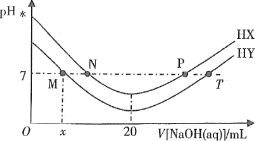
下列推断正确的是
A.HX的电离方程式为HX=H++X-
B.T点时c(Na+)=c(Y-)>c(H+)=c(OH-)
C.常温下用蒸馏水分别稀释N、P点溶液,pH都降低
D.常温下,HY的电离常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用于驱动潜艇的液氨![]() 液氧燃料电池原理示意如图,下列有关该电池说法正确的是
液氧燃料电池原理示意如图,下列有关该电池说法正确的是
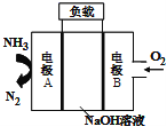
A.该电池工作时,每消耗22.4LNH3转移3mol电子
B.电子由电极A经外电路流向电极B
C.电池工作时,OH-向电极B移动
D.电极B上发生的电极反应为: ![]() H2O
H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应方程式书写正确的是( )
A.2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
B.CH2=CH2+HCl→CH2CH3Cl
C.CH3COOH+CH3CH2OH![]() CH3COCH3CH2O+H2O
CH3COCH3CH2O+H2O
D.![]() +Br2
+Br2![]()
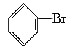
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(1)铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4═2PbSO4+2H2O。正极电极反应式为__,随着反应的进行,正极附近溶液的酸性将__。
(2)FeCl3溶液常用于腐蚀印刷电路铜板,发生2FeCl3+Cu═2FeCl2+CuCl2,若将此反应设计成原电池,则负极所用电极材料为__,当线路中转移0.4mol电子时,则被腐蚀铜的质量为__g。
(3)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为__。
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片 D.铜片、铜片
(4)如图是一种新型燃料电池,以CO为燃料,一定比例的Li2CO3和Na2CO3的熔融混合物为电解质,A极为电源(填“正”或“负”)___极,写出A极的电极反应式:___。
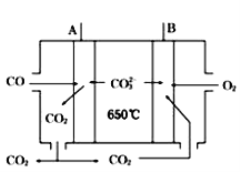
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com