
【题目】某研究小组的同学用下图所示装置进行氯气的性质实验。
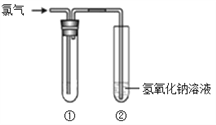
请回答:
(1)若要得到干燥的氯气,则①中所加的试剂应为_____。
(2)若①中盛放的是湿润的红纸条,则观察到的现象为_____。
(3)若①要验证氯气具有氧化性,则所用的溶液不能是_____(填序号)。
a. FeCl2 b. 溴水 c. KI溶液
(4)装置②中反应的离子方程式是_____。
【答案】 浓硫酸 湿润的红纸条褪色 b Cl2 + 2OH- = Cl- + ClO- + H2O
【解析】结合所给装置,干燥氯气需用浓硫酸;氯水具有漂白性,能使湿润的红纸条褪色;氯气具有氧化性,可以通过和还原性物质反应产生现象来要验证氯气具有氧化性;装置②中发生的是氯气和氢氧化钠的反应,以此分析。
结合以上分析(1)若要得到干燥的氯气,则①中所加的试剂应为浓硫酸。
(2)若①中盛放的是湿润的红纸条,因为氯水具有漂白性,所以可观察到的现象为湿润的红纸条褪色。
(3)a. 将氯气通入FeCl2溶液,FeCl2被氯气氧化,溶液由浅绿色变为棕黄色,可以证明氯气具有氧化性,a正确;b.将氯气通入溴水不反应,故b错误;c. 将氯气通入KI溶液溶液,KI溶液被氯气氧化生成I2,溶液由无色变为黄色,可以证明氯气具有氧化性,c正确;因此本题答案选b。
(4)装置②中用氢氧化钠溶液吸收多余氯气,反应的离子方程式是Cl2 + 2OH- =Cl- + ClO- + H2O。因此本题答案为:Cl2 + 2OH- = Cl- + ClO- + H2O。


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】2016年9月我国成功利用大功率运载火箭发射“天宫二号”空间实验室。火箭推进器中装有还原剂肼(N2H4)(液态)和强氧化剂过氧化氢(H2O2),如图是一定量肼完全反应生成氮气和水过程中的能量变化图。请回答下列问题:
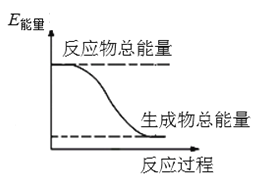
(1)肼又名联氨,请推测它的结构式:__________________________。
(2)液态肼与过氧化氢的反应属于________(填“吸热”或“放热”)反应。
(3)写出该火箭推进器中相关反应的化学方程式:_____________________。
(4)已知肼和氧气可发生如下反应:N2H4(g)+O2(g)N2(g)+2H2O(g)
①某温度下,容积固定的密闭容器中,下列描述可说明上述反应达到平衡的是______。
A. υ(N2) = υ(N2H4)
B. c(N2H4) : c(O2) : c(N2) = 1:1:1
C. 混合气体的密度不再发生变化
D. 体系的压强不再发生变化
E. 混合气体的平均相对分子质量不再发生变化
F. 每断开1 mol O=O键,同时断开4 mol H-O键
②若想要增加该反应的正反应速率,你认为一定可行的方法有:____________。
A. 升高反应温度 B. 加入适当的催化剂
C. 向容器中加入氧气 D. 向容器中加入氖气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 向氢氧化钡溶液中加入硫酸氢钠至溶液为中性:Ba2++2OH-+2H++SO42-==BaSO4↓+2H2O
B. 电解氯化镁溶液:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
C. 氯气与水反应:Cl2+H2O==2H++Cl-+ClO-
D. 向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO3-+OH-==CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2A(g)+B(g)3C(g)+4D(g)的反应,在不同条件下的反应的速率最快的是( )
A.v(A)=0.7molL﹣1min﹣1
B.v (B)=0.3molL﹣1min﹣1
C.v (C)=0.9molL﹣1min﹣1
D.v (D)=0.8molL﹣1s﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知气态烃A的密度是相同状况下氢气密度的14倍,有机物A~E能发生下图所示一系列变化,则下列说法错误的是
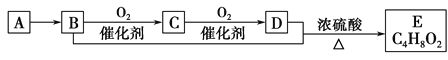
A. A分子中所有原子均在同一平面内
B. C4H8O2含酯基的同分异构体有4种
C. C的水溶液又称福尔马林,具有杀菌、防腐性能
D. 等物质的量的B、D与足量钠反应生成气体的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(实验题)为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)
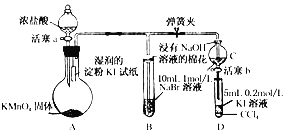
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a
Ⅳ.……
(1)A中产生黄绿色气体,其电子式是____________________
(2)验证氯气的氧化性强于碘的实验现象是____________________
(3)B中溶液发生反应的离子方程式是____________________
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是__________________________________________
(5)过程Ⅲ实验的目的是____________________
(6)氯溴碘单质的氧化性逐渐减弱的原因:同主族元素从上到下_________,得电子能力逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】木炭、活性炭、炭黑、焦炭是由石墨的微小晶体和少量杂质构成的,均属混合物。没有固定的几何外形,所以称为无定形碳,在工业上有着重要用途。回答下列问题:
(1)木炭与硫黄、火硝(硝酸钾)按一定比例混合即为黑火药。黑火药爆炸时生成硫化钾、氮气和二氧化碳。黑火药爆炸的化学方程式为____________。若有15g木炭参加反应,转移电子数为____________。
(2)工业上的炭黑是由烃类裂解而制得的高度分散性的黑色粉末状物质。
①已知几个反应的热化学方程式:
C(s)+O2 (g)CO2(g) ΔH1=393.5 kJmol1
2H2(g)+O2 (g)2H2O(1) ΔH2=571.6 kJmol1
CH4(g)+2O2(g)CO2(g)+ 2H2O(1) ΔH3=890.3 kJmol1
则由天然气生产炭黑的热化学方程式为____________。
②右图是温度对天然气生产炭黑转化率的影响,下列有关说法正确的是____________。
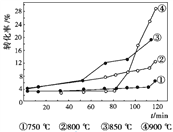
A. 甲烷裂解属于吸热反应
B. 增大体系压强,能提高甲烷的转化率
C. 在反应体系中加催化剂,反应速率增大
D. 升高温度,该反应的平衡常数减小
(3)活性炭可以用来净化气体和液体。
①用活性炭还原氮氧化物,可防止空气污染。向1 L密闭容器加入一定量的活性炭和NO,某温度下发生反应C(s)+ 2NO(g)![]() N2(g)+CO2(g),测得不同时间内各物质的物质的量如下表:
N2(g)+CO2(g),测得不同时间内各物质的物质的量如下表:
物质的量/mol 时间/min | NO | N2 | CO2 |
0 | 0.200 | 0 | 0 |
10 | 0.116 | 0.042 | 0.042 |
20 | 0.080 | 0.060 | 0.060 |
30 | 0.080 | 0.060 | 0.060 |
此温度下,该反应的平衡常数K=____________ (保留两位小数)。10~20min内,NO的平均反应速率为____________;若30 min后升高温度,达到新平衡时,容器中c(NO)∶c(N2)∶c(CO2)=2∶1∶1,则该反应的ΔH____________0(填“>”、“<”或“=”)。
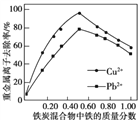
②活性炭和铁屑混合可用于处理水中污染物。在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中span>Cu2+和Pb2+的去除率,结果如图所示。当混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,其原因是____________;当混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物可能由NaCl、NaI、NH4Cl、Na2CO3、Na2SO3、Na2SO4中的一种或几种组成,准确称取4.7g该固体混合物进行如下实验(所加试剂均足量,气体体积已折算成标准状况下) :
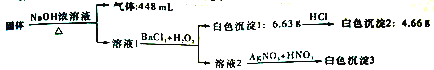
根据实验结果,下列有关说法不正确的是
A. 原固体混合物中是否含有NaCl无法确定
B. 若溶液1中只加BaCl2,则生成白色沉淀的质量必小于6.63 g
C. 原固体混合物中必含有NH4Cl、Na2CO3、Na2SO3
D. 测定出“白色沉淀3”的质量可以确定原固体混合物的组成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com