
【题目】下列指定反应的离子方程式正确的是
A. 向氢氧化钡溶液中加入硫酸氢钠至溶液为中性:Ba2++2OH-+2H++SO42-==BaSO4↓+2H2O
B. 电解氯化镁溶液:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
C. 氯气与水反应:Cl2+H2O==2H++Cl-+ClO-
D. 向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO3-+OH-==CaCO3↓+H2O
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:
【题目】碳、及其化合物在生产中有重要应用。
(1)设反应 ① Fe(s) + CO2(g)![]() FeO(s) + CO(g) ⊿H = Q1 平衡常数为K1
FeO(s) + CO(g) ⊿H = Q1 平衡常数为K1
② Fe(s) + H2O(g)![]() FeO(s) + H2(g) ⊿H = Q2 平衡常数为K2
FeO(s) + H2(g) ⊿H = Q2 平衡常数为K2
不同温度下,K1、K2的值如下表
T/K | K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
现有反应 ③ H2(g) + CO2(g)![]() CO(g) + H2O(g) ⊿H = Q3,结合上表数据,根据反应①、②推导出Q1、Q2、Q3的关系式Q3=_____________,反应③是________(填“放”或“吸”)热反应。
CO(g) + H2O(g) ⊿H = Q3,结合上表数据,根据反应①、②推导出Q1、Q2、Q3的关系式Q3=_____________,反应③是________(填“放”或“吸”)热反应。
(2)已知CO2催化加氢合成乙醇的反应原理为:2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g) ⊿H <0
C2H5OH(g)+3H2O(g) ⊿H <0

①图l、图2分别是CO2的平衡转化率随压强及温度的变化关系,已知m为起始时的投料比,即m=n(H2)/n(CO2),图l中投料比相同,温度从高到低的顺序为________,图2中m1、m2、m3从大到小的顺序为_____________。
②图3表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。则曲线d代表的物质为________(填化学式),T4温度时,该反应的平衡常数Kp=________。(提示:用平衡分压代替平衡浓度来计算,某组分平衡分压=总压×该组分的物质的量分数,结果保留小数点后三位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、M 为原子序数依次增大的短周期主族元素。已知:①元素对应的原子半径大小为:X<Z<Y<M<W;② Y 是组成有机物的必要元素 ③ Z 与 X 可形成两种常见的共价化合物,与 W 可形成两种常见的离子化台物;④ M 的电子层数与最外层电子数相等。下列说法不正确的是
A. W、M 的原子半径为 M<W
B. YZ2为直线形的共价化合物,W2Z2既含有离子键又含有共价键
C. Z 与 X 形成的化合物的熔沸点偏高是因其分子内存在氢键
D. Z 与 M 形成的化合物可作为耐高温材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1998年诺贝尔化学奖授予科恩(美)和波普尔(英)以表彰他们在理论化学领域作出的重大贡献。他们的工作使实验和理论能够共同协力探讨分子体系的性质,引起整个化学领域正在经历一场革命的变化。下列说法正确的是
A.化学不再是纯实验科学B.化学不再需要实验
C.化学不做实验,就什么都不知道D.未来化学的方向还是经验化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度为0.50mol·L-1的某金属阳离子Mn+的溶液10.00mL,与0.40mol·L-1的NaOH溶液12.50mL完全反应,生成沉淀,则n等于
A.1B.2C.3D.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中能大量共存并且溶液为无色透明的离子组是( )
A.Ca2+、Na+、NO3-、SO42-B.Mg2+、Cl-、Al3+、SO42-
C.K+、Cl-、HCO3-、NO3-D.Ca2+、Na+、Fe3+、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组的同学用下图所示装置进行氯气的性质实验。
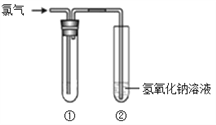
请回答:
(1)若要得到干燥的氯气,则①中所加的试剂应为_____。
(2)若①中盛放的是湿润的红纸条,则观察到的现象为_____。
(3)若①要验证氯气具有氧化性,则所用的溶液不能是_____(填序号)。
a. FeCl2 b. 溴水 c. KI溶液
(4)装置②中反应的离子方程式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.
(1)已知CH3OH(g)+ ![]() O2(g)
O2(g)![]() CO2(g)+2H2(g)能量变化如图,下列说法正确的是______
CO2(g)+2H2(g)能量变化如图,下列说法正确的是______
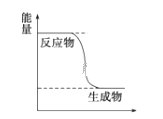
A.CH3OH转变成H2的过程是一个吸收能量的过程
B.H2的生成速率与CH3OH的消耗速率之比为1:2
C.化学变化不仅有新物质生成,同时也一定有能量变化
D.1molH-O键断裂的同时2molC=O键断裂,则反应达最大限度
(2)某温度下,将5molCH3OH和2molO2充入2L的密闭容器中,经过4min反应达到平衡,测得c(O2)=0.2mol·L-1,4min内平均反应速度v(H2)=__________ ,则CH3OH的转化率为______ 。
(3)甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气、KOH(电解质溶液)构成,则下列说法正确的是 ______
A.电池放电时通入空气的电极为负极
B.电池放电时负极的电极反应式为CH3OH-6e-=CO2↑+2H2O
C.电池放电时,电解质溶液的碱性逐渐减弱
D.电池放电时每消耗6.4gCH3OH转移1.2mol电子
(4)写出甲醇燃料电池在酸性条件下负极的反应式为 ______ .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com