
【题目】在强酸性溶液中能大量共存并且溶液为无色透明的离子组是( )
A.Ca2+、Na+、NO3-、SO42-B.Mg2+、Cl-、Al3+、SO42-
C.K+、Cl-、HCO3-、NO3-D.Ca2+、Na+、Fe3+、NO3-
 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
【题目】有资料显示过量的 NH3 和 Cl2 在常温下可合成岩脑砂(主要成分为 NH4Cl),某实验小组对该反应进行探究,并对岩脑砂进行元素测定,回答下列问题:
(1)岩脑砂的制备
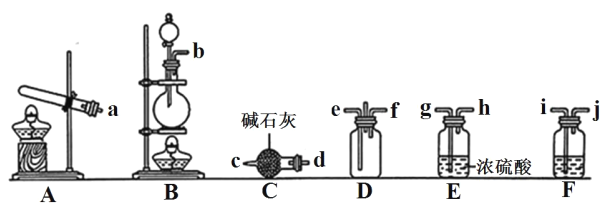
①利用装置 A 制取实验所需的 NH3,写出反应的化学方程式:_______。
②已知该实验中用浓盐酸与 MnO2 反应制取所需 Cl2,装罝 F中的试剂是饱和食盐水,则 F装置的作用是_______。
③为了使NH3和Cl2在D中充分混合,请确定上述装置的合理连接顺序:_______→e f←_______(用小写字母和箭头表示,箭头方向与气流方向一致)。
④证明NH3和Cl2反应有岩脑砂生成,需要用到的实验用品中除了蒸馏水、稀 HNO3、 红色石蕊试纸外,还需要用到的试剂有_______。(填试剂的化学式)
(2)岩脑砂中元素的测定
准确称取 a g 岩脑砂,与足量的氧化铜混合加热,利用下列装置测定岩脑砂中氮元素和氯元素的物质的量之比。(已知该过程发生的反应为:2NH4Cl+3CuO![]() 3Cu+N2↑+2HCl↑+3H2O)
3Cu+N2↑+2HCl↑+3H2O)
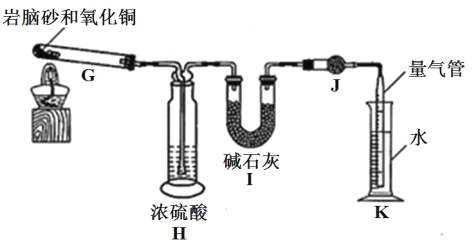
⑤设置装置 H 的目的是______。
⑥若装置 I 增重 b g,利用装置 K 测得气体体积为 V L(已知常温常压下的气体摩尔体积为 24.5L·mol-1),则岩脑砂中 n(N):n(Cl)= ______(用含 b、V的代数式表示,不必化简)。
⑦若测量体积时气体温度高于常温(其他操作均正确),则 n(N)比正常值______ (填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 向氢氧化钡溶液中加入硫酸氢钠至溶液为中性:Ba2++2OH-+2H++SO42-==BaSO4↓+2H2O
B. 电解氯化镁溶液:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
C. 氯气与水反应:Cl2+H2O==2H++Cl-+ClO-
D. 向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO3-+OH-==CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究有机物A的组成与结构,进行了如下实验:
①称取A18.0g,升温使其汽化,测其密度是相同条件下H2的45倍;
②称取9.0g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g
③另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24L H2(标准状况)
④A的核磁共振氢谱中,氢原子个数比为1:2:2:1
综上所述,A的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2A(g)+B(g)3C(g)+4D(g)的反应,在不同条件下的反应的速率最快的是( )
A.v(A)=0.7molL﹣1min﹣1
B.v (B)=0.3molL﹣1min﹣1
C.v (C)=0.9molL﹣1min﹣1
D.v (D)=0.8molL﹣1s﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(实验题)为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)
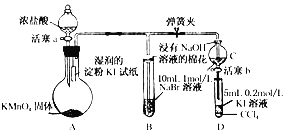
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a
Ⅳ.……
(1)A中产生黄绿色气体,其电子式是____________________
(2)验证氯气的氧化性强于碘的实验现象是____________________
(3)B中溶液发生反应的离子方程式是____________________
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是__________________________________________
(5)过程Ⅲ实验的目的是____________________
(6)氯溴碘单质的氧化性逐渐减弱的原因:同主族元素从上到下_________,得电子能力逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳循环(如图)对人类生存、发展有着重要的意义。下列说法错误的是
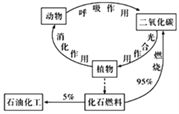
A. 碳是构成有机物的主要元素
B. 石油的年产量是一个国家石油化工发展水平的标志
C. 化石燃料的大量燃烧是产生温室效应的原因之一
D. 光合作用是将太阳能转化为化学能的过程
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com