
某研究性学习小组在研究化学反应中的能量变化时,做了下面的实验:

在一个小烧杯里,加入20 g已研磨成粉末的Ba(OH)2·8H2O,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯中加入约10 g NH4Cl晶体,根据实验步骤,填写下表,并回答问题。
| 实验步骤 | 实验现象及结论 |
| 将晶体混合,立即快速搅拌 | 有刺激性气味能使湿润的紫色石蕊试纸变蓝的 ① 产生 |
| 用手摸烧杯下部 | 感觉烧杯变凉说明此反应是 ② 反应 |
| 用手拿起烧杯 | 烧杯下面的带有几滴水的玻璃片粘到了烧杯底部 |
| 将粘有玻璃片的烧杯放在盛有热水的烧杯上 | 玻璃片脱离上面烧杯底部 |
| 反应后移走多孔塑料片观察反应物 | 混合物成糊状,证明有 ③ 生成 |
① ② ③
④写出实验过程中发生反应的化学方程式:____________________。
⑤实验中要立即用玻璃棒迅速搅拌的原因是: __________________。
⑥在上述实验过程中,为什么用浸有稀硫酸的湿棉花置于多孔塑料板上?
______________________________________________________。
科目:高中化学 来源: 题型:
 中草药秦皮中含有的七叶树内酯(每个折点表示一个碳原子,氢原子未画出),具有抗菌作用。若1mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为
中草药秦皮中含有的七叶树内酯(每个折点表示一个碳原子,氢原子未画出),具有抗菌作用。若1mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为
A.2molBr2、2molNaOH B.2molBr2、3molNaOH
C.3molBr2、4molNaOH D.4molBr2、4molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
欲检验CO2气体中是否含有SO2、HC1,进行如下实验:
①将气体通入酸化的AgNO3溶液中,产生白色沉淀a;
②滤去沉淀a,向滤液中加入Ba(NO3)2溶液,产生白色沉淀b。
下列说法正确的是 ( )
A.沉淀a为AgC1 B.沉淀b为BaCO3 C.气体中含有SO2 D.气体中没有HC1
查看答案和解析>>
科目:高中化学 来源: 题型:
向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液。下列图象中能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量)
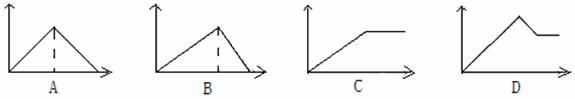
查看答案和解析>>
科目:高中化学 来源: 题型:
下列条件一定能使化学反应速率增大的是
①增加反应物的量 ②升高温度 ③缩小反应容器的体积 ④加入生成物
A.只有② B.只有②③ C.只有①② D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物分子中含有下列基团:2个 、2个-CH2-、3个-CH3和一个-COOH,该有机物可能的结构有(不考虑立体异构)( )
、2个-CH2-、3个-CH3和一个-COOH,该有机物可能的结构有(不考虑立体异构)( )
A.8种 B.9种 C.10种 D.11种
查看答案和解析>>
科目:高中化学 来源: 题型:
环己酮是一种重要的化工原料,已知实验室制备环己酮的原理为 。现用如图装置制备环己酮(部分夹持仪器未画出):
。现用如图装置制备环己酮(部分夹持仪器未画出):

合成装置 精制装置
环己醇、环己酮和水的部分物理性质见下表(*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点):
| 物质 | 相对分子质量 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
| 环己醇 | 100 | 161.1(97.8)* | 0.9624 | 微溶于水 |
| 环己酮 | 98 | 155.6(95)* | 0.9478 | 微溶于水 |
| 水 | 18 | 100.0 | 0.9982 |
(1)已知合成环己酮的反应是放热反应,反应剧烈将导致体系温度迅速上升,副反应增多。实验时,先在合成装置中加入5.0mL环己醇和几粒沸石,再加入酸性Na2Cr2O7溶液。酸性Na2Cr2O7溶液的加料方式为_________(填字母)。
A.一次性加入 B.缓慢加入 C.无所谓,怎样加入都可以
(2)若酸性Na2Cr2O7溶液的体积为35mL,则应选取____________(填“100mL”或“250mL”)的三颈瓶。
(3)回流两小时反应完成后,加入适量水,换上冷凝收集装置后蒸馏,收集95~100℃的馏分A,其主要成分是____________的混合物。
(4)合成装置中冷凝管的作用是_________________,冷凝水从冷凝管的______(填“a”或“b”)口进入。
(5)在馏分A中加入氯化钠固体至饱和,静置、分液,得有机层B。加入氯化钠固体的作用是________________________________。
(6)在有机层B中加入无水硫酸镁固体,除去其中的少量水分。过滤,将滤液置于精制装置中蒸馏,收集____________(填字母)的馏分,得到纯净的环己酮。
A.100.0~102.0℃ B.154.0~156.0℃ C.160.0~162.0℃
(7)精制装置中的两处错误分别是:_________________、______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
元素性质呈周期性变化的决定因素是 ( )
A.元素原子核外电子层排布呈周期性变化 B.元素相对原子质量依次递增
C.元素原子半径大小呈周期性变化 D.元素的最高正化合价呈周期性变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com