
【题目】如表列出了①~⑧八种元素在周期表中的位置:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | |||||||
3 | ② | ③ | ④ | ⑤ | ⑦ | |||
4 | ⑥ | ⑧ |
请按要求回答下列问题:
(1)②、③、④三种元素的最高价氧化物对应的水化物,其中碱性最强的是__(填写化学式)。
(2)②、③、⑥三种元素按原子半径由大到小的顺序排列为__(用元素符号表示)。
(3)元素③的原子结构示意图是__/span>。元素⑤的单质的导电性介于导体和绝缘体之间,因此是一种良好的__材料。
(4)向元素②的单质与水反应后的溶液中加入元素④的单质,发生反应的化学方程式为___。
(5)用离子方程式证明⑦⑧两元素非金属性的强弱__。
【答案】NaOH K>Na>Mg ![]() 半导体 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ Cl2+2Brˉ=Br2+2Clˉ
半导体 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ Cl2+2Brˉ=Br2+2Clˉ
【解析】
由表可知①~⑧号元素的种类分别是:①是N;②是Na;③是Mg;④是Al;⑤是Si;⑥是K;⑦是Cl;⑧是Br;由此分析解答。
(1)②是Na;③是Mg;④是Al,金属性最强的是钠,则Na的最高价氧化物对应水化物NaOH的碱性最强;
(2)电子层数越多半径越大,电子层数相同时,核电荷数越多半径越小,所以半径由大到小的顺序排列为K>Na>Mg;
(3)镁原子的结构示意图为:![]() ;硅是半导体材料;
;硅是半导体材料;
(4)向元素钠的单质与水反应后的溶液是氢氧化钠,其中加入元素铝的单质,发生反应的化学方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
(5)通过单质之间的置换反应来证明非金属性的强弱,反应的化学方程式为:Cl2+2Brˉ═Br2+2Clˉ。


科目:高中化学 来源: 题型:
【题目】实验室分离Fe3+和Al3+的流程如下:
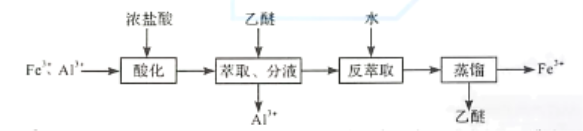
知Fe3+在浓盐酸中生成黄色配离子(FeCl4),该配离子在乙醚(Et2O,沸点34.6℃)中生成缔合物![]() 。下列说法错误的是
。下列说法错误的是
A.萃取振荡时,分液漏斗下口应倾斜向下
B.分液时,应先将下层液体由分液漏斗下口放出
C.分液后水相为无色,说明已达到分离目的
D.蒸馏时选用直形冷凝管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据原子结构、元素周期表和元素周期律的知识回答下列问题:
(1)A元素次外层电子数是最外层电子数的![]() ,其外围电子排布图是__________。
,其外围电子排布图是__________。
(2)B是1~36号元素原子核外电子排布中未成对电子数最多的元素,B元素的名称是____,价层电子排布式_________,在元素周期表中的位置是____________。
(3)C元素基态原子的电子排布图是下图中的____(填序号),另一个不能作为基态原子的电子排布图因为它不符合__(填序号)。
①
②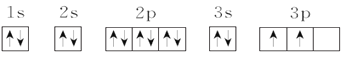
A.能量最低原理 B.泡利原理 C.洪特规则
(4)第三周期元素的气态电中性基态原子失去最外层一个电子转化为气态基态正离子所需的最低能量叫作第一电离能(设为E)。如图所示:
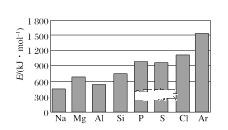
①同周期内,随着原子序数的增大,E值变化的总趋势是____;
②根据图中提供的信息,可推断出E氧____E氟(填“>”“<”或“=”,下同);
③根据第一电离能的含义和元素周期律,可推断出E镁___E钙。
(5)判断BCl3分子的空间构型、中心原子成键时采取的杂化轨道类型及分子中共价键的键角:________、___________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)在地壳中含量不大,但砷的化合物却丰富多彩。
(1)基态砷原子的电子排布式为________;砷与溴的第一电离能较大的是____________。
(2)AsH3是无色稍有大蒜味的气体。AsH3的沸点高于PH3,其主要原因是________________________________________________________________。
(3)Na3AsO4可作杀虫剂。AsO43-的空间构型为________,与其互为等电子体的一种分子为________。
(4)某砷的氧化物俗称“砒霜”,其分子结构如图所示。该化合物的分子式为____________,As原子采取________杂化。
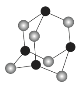
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似,GaAs晶体中,As与Ga之间存在的化学键有________(填字母)。
A.离子键 B.σ键 C.π键 D.氢键 E.配位键 F.金属键 G.极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )
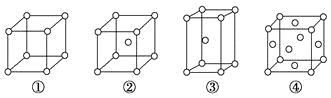
A. ①为简单立方堆积 ②为六方最密堆积 ③为体心立方堆积 ④为面心立方最密堆积
B. 每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C. 晶胞中原子的配位数分别为:①6,②8,③8,④12
D. 空间利用率的大小关系为:①<②<③<④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据官能团的不同对下列有机物进行分类:
①CH3CH2OH ②![]() ③CH3CH2Br ④
③CH3CH2Br ④![]() ⑤
⑤![]() ⑥
⑥![]() ⑦
⑦![]() ⑧
⑧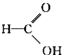 ⑨
⑨![]() ⑩
⑩![]()
(1)芳香烃:___;卤代烃:___。
(2)醇:___;酚:___;醛:___;酮:___。
(3)羧酸:___;酯:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】强酸性溶液X中可能含有Na+、K+、NH4+、Fe2+、A13+、CO32-、SO32-、SO42-、C1-中的若干种,某同学为了确认其成分,取X溶液进行连续实验,实验过程及产物如下:

下列结论正确的是
A. X中肯定存在Na+、Fe2+、A13+、NH4+、SO42-
B. 气体F经催化氧化可直接生成气体D
C. 沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3 、沉淀I一定是Al(OH )3
D. X中不能确定的离子是 A13+、Na+、K+和C1-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制100 mL 1.0 mol/LNa2CO3溶液,下列操作正确的是
A. 称取10.6 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容
B. 称取10.6 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解
C. 转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中
D. 定容后,塞好瓶塞,反复倒转、摇匀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com