
����Ŀ����100��ʱ����0.200mol�������������������2L��յ��ܱ������У�ÿ��һ����ʱ��Ը������ڵ����ʽ��з������õ������
| 0 | 2 | 4 | 6 | 8 | 10 |
c��N2O4�� | 0.100 | c1 | 0.050 | c3 | a | b |
c��NO2�� | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
����գ�
��1���÷�Ӧ�ﵽƽ��ʱ��������������ת����Ϊ%������c2c3��ab�����������������=������
��2��2minʱ������������Ũ��c1=mol/L����0��2minʱ����ڣ�������������ƽ����Ӧ����Ϊmol/��Lmin����
��3��100��ʱ���÷�Ӧ��ƽ�ⳣ��K=
��4��������ͬ���������������������Ƕ����������壬Ҫ�ﵽ����ͬ����ƽ��״̬��������������ʼŨ����mol/L��
���𰸡�
��1��60��>��=
��2��0.070��0.015
��3��0.36
��4��0.200
���������⣺��1��ͼ�����ݷ�����֪��Ӧ�Ļ�ѧ����ʽΪ��N2O42 NO2 ��
�ɱ���֪��6minʱ��Ӧ��ƽ�⣬c��NO2��=0.120mol/L��
N2O4 | 2NO2 | ||
Ũ�ȱ仯 | 0.06mol/L | 0.120mol/L |
����ƽ��ʱN2O4��ת����Ϊ ![]() =60%��
=60%��
4minʱƽ�����ƣ�c2��c3 �� 60sʱc��NO2�����ٱ仯����Ӧ�ﵽƽ�⣬a=b��
���Դ��ǣ�60������=��
2���ɱ���֪��2minʱ��c��NO2 ��=0.060mol/L������
N2O4 | 2NO2 | ||
Ũ�ȱ仯 | 0.03mol/L | 0.060mol/L |
����2min��������������Ũ��c1=0.1mol/L��0.03mol/L=0.07mol/L��
��0��2min��������������ƽ����Ӧ����Ϊv��N2O4��= ![]() =0.015mol/��Lmin����
=0.015mol/��Lmin����
���Դ��ǣ�0.070��0.015��
3��
N2O4 | 2NO2 | ||
��ʼ��mol/L�� | 0.100 | 0 | |
�仯��mol/L�� | 0.060 | 0.120 | |
ƽ�⣨mol/L�� | 0.040 | 0.120 |
ƽ�ⳣ��k= ![]() =
= ![]() =0.36��
=0.36��
���Դ��ǣ�0.36��
4�����º��������£��ҷ�Ӧǰ����������ʵ��������仯����ʼ�������г�����Ƕ����������壬Ҫ�ﵽ��ͬ��ƽ��״̬������ѧ������ת����N2O4һ�ߣ�����N2O4��Ũ��Ϊ0.100mol/L����N2O4��g��2NO2��g����֪�����������ij�ʼŨ��=2��0.100mol/L=0.200mol/L��
���Դ��ǣ�0.200��
�����㾫����������Ĺؼ��������⻯ѧƽ��ļ�������֪ʶ�����շ�Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ᡢ�������������ѧ�γ����ġ������ᡱ���־��������������Ӧ��������ش��������⣺
��1��ϡ�����Cu��Ӧ������ϡ�����м���H2O2����������������������ʱ��ԭ����Ϊˮ�������ʹͭ˳���ܽ⣮�÷�Ӧ�Ļ�ѧ����ʽΪ�� ��
��2����һ�������10molL��1��Ũ�����м������ͭƬ������ʹ֮��Ӧ������ԭ������Ϊ0.9mol����Ũ�����ʵ�����������ڡ��������ڡ���С�ڡ���180mL����ʹʣ���ͭƬ�����ܽ⣬�������м�����������Һ����KNO3��Һ������÷�Ӧ�����ӷ���ʽΪ ��
��3����Ѹ�ٳ�ȥ�����ײ���ˮ�����ֲ�����������õķ�����
A.Ũ����
B.ϡ����
C.���Ũ����
D.���Ũ���ᣮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϡ������ϡNaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺ 
��1����ͼ��������δ�������������ձ��Ϸ�����ĭ���ϸǺ� �� ��ĭ���ϵ������� ��
��2����NaOH��Һ����ͬŨ�Ⱥ������������Һ���棬����к�����ֵ�ⶨ��������Ӱ�죨�ƫ����ƫС��������Ӱ�족����KOH��Һ����ˮ��NH3H2O�� ��
��3��ij�о�С�齫V1 mL 1.0mol/L HCl��Һ��V2 mLδ֪Ũ�ȵ�NaOH��Һ��Ͼ��Ⱥ��������¼��Һ�¶ȣ�ʵ������ͼ��ʾ��ʵ����ʼ�ձ���V1+V2=50mL��������ɼ�ͼ�ο�֪��V1��V2=ʱ�����ǡ����ȫ�кͣ��˷�Ӧ����NaOH��Һ��Ũ��ӦΪmol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ksp(AgCl)=1.8��10-10 �� Ksp(AgI)=1.5��10-16 �� Ksp(Ag2CrO4)=2.0��10-12 �� �����������εı�����Һ�У�Ag+Ũ�ȴ�С˳����ȷ���ǣ� ��
A.AgCl >AgI> Ag2CrO4
B.AgCl> Ag2CrO4 >AgI
C.Ag2CrO4>AgCl >AgI
D.Ag2CrO4>AgI >AgCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij����ϡ��Һ����ʱ����������������ǣ� ��
A.����ĵ���̶�����B.������ӵ�Ũ�ȼ�С
C.��Һ��c(OH-)����D.��Һ�ĵ�������ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ���ǣ� ��
A.������̼����Ԫ�ص�����������ͬ����Ϊͬϵ��
B.CH2�TCH2��CH2�TCH��CH�TCH2��Ϊͬϵ��
C.![]() ��
�� ![]() ��Ϊͬ���칹��
��Ϊͬ���칹��
D.ͬ���칹��Ļ�ѧ���ʿ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����û�ѧԭ�����ԶԹ����ŷŵķ�ˮ�������Ƚ�����Ч��⣮ij�������Ƹ���ҵ������Cr�������������ù������£������Һ�н���������Ҫ��Cr3+ �� �����Fe3+ �� Fe2+ �� Al3+ �� Ca2+ �� Mg2+�� 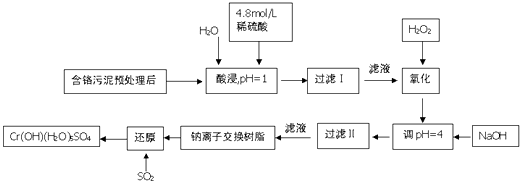
�����²��������ӵ����������γɳ���ʱ��Һ��pH���±���
������ | Fe3+ | Fe2+ | Mg2+ | Al3+ | Ca2+ | Cr3+ |
��ʼ����ʱ��pH | 1.9 | 7.0 | 9.6 | 4.2 | 9.7 | �� |
������ȫʱ��pH | 3.2 | 9.0 | 11.1 | 8.0 | 11.7 | 9.0����9.0�ܽ⣩ |
��1�����ʱ��Ϊ����߽�ȡ�ʿɲ�ȡ�Ĵ�ʩ��������һ����
��2����pH=4.0��Ϊ�˳�ȥ����Fe3+ �� Al3+ �� Ca2+ �� Mg2+��
��3�������ӽ�����֬��ԭ��ΪMn++n NaR��MRn+nNa+ �� ����������������������Fe3+ �� Al3+ �� Ca2+ �� Mg2+��
��4������ƽ����������ԭ��Ӧ����ʽ��Na2Cr2O7+SO2+H2O=Cr��OH����H2O��5SO4+Na2SO4 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ҭ������Ȼ��Ȫˮ�ijɷ֣�����46.31g/L������35.11g/L������0.051g/L������������ɷ��ơ��ơ���ָ���ǣ� ��
A.Ԫ��
B.����
C.ԭ��
D.������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼΪ�������ȡ����Ӧ��ʵ��װ��ͼ������AΪ�ɾ���֧�ܵ��Թ��Ƴɵķ�Ӧ�����������¶˿���һ��С�ף�����ʯ���ޣ��ټ���������м�ۣ� 
��д���пհף�
��1����Ӧ����A����μ�����ͱ��Ļ��Һ���������ھͷ�����Ӧ��д��A����������Ӧ�Ļ�ѧ����ʽ���л���д�ṹ��ʽ���� ��
��2���Թ�C�б��������� �� ��Ӧ��ʼ�۲�D��E���Թܣ�����������Ϊ ��
��3����Ӧ2��3min����B�е�NaOH��Һ��ɹ۲쵽�������� ��
��4������������װ���У����з��������õ�������������ĸ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com