
【题目】图为苯和溴的取代反应的实验装置图,其中A为由具有支管的试管制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量铁屑粉. 
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应.写出A中所发生反应的化学方程式(有机物写结构简式): .
(2)试管C中苯的作用是 . 反应开始后,观察D和E两试管,看到的现象为 .
(3)反应2~3min后,在B中的NaOH溶液里可观察到的现象是 .
(4)在上述整套装置中,具有防倒吸作用的仪器有(填字母).
【答案】
(1)2Fe+3Br2=2FeBr3 , ![]()
(2)吸收HBr气体中的Br2蒸气;D中紫色石蕊溶液变红,E中产生淡黄色沉淀
(3)NaOH溶液的底部有无色油珠产生,液面上产生白雾
(4)DEF
【解析】解:液溴和苯的混合物滴加到有铁粉的石棉绒上,液溴和苯在Fe作催化剂条件下能发生取代反应生成溴苯与HBr,溴和苯都是易挥发的物质,所以反应生成的溴苯及大部分未的反应苯和溴流入到下面的氢氧化钠溶液中,生成的溴化氢及挥发出的溴、苯通过C装置,苯和溴被吸收,溴化氢气体到D装置中能使石蕊变红,在E装置中溴化氢使硝酸银产生浅黄色沉淀,尾气用氢氧化钠吸收,由于溴化氢极易溶于水,所以F装置要用防止倒吸装置,(1)Fe与溴反应生成溴化铁,苯和液溴在溴化铁作催化剂条件下能发生取代反应生成溴苯与HBr,反应方程式为:2Fe+3Br2=2FeBr3 , ![]() ,故答案为:2Fe+3Br2=2FeBr3 ,
,故答案为:2Fe+3Br2=2FeBr3 , ![]() ;(2)溴易挥发,易溶于有机溶剂,所以用C来吸收吸收溴化氢中的溴和挥发的有机物蒸汽,防止对溴化氢的检验造成干扰;溴化氢溶于水电离产生氢离子和溴离子,所以溶液显酸性,能使石蕊变红色,硝酸银中的银离子与溴离子反应生成淡黄色的沉淀;
;(2)溴易挥发,易溶于有机溶剂,所以用C来吸收吸收溴化氢中的溴和挥发的有机物蒸汽,防止对溴化氢的检验造成干扰;溴化氢溶于水电离产生氢离子和溴离子,所以溶液显酸性,能使石蕊变红色,硝酸银中的银离子与溴离子反应生成淡黄色的沉淀;
故答案为:吸收HBr气体中的Br2蒸气;D中紫色石蕊溶液变红,E中产生淡黄色沉淀;(3)苯与液溴发生取代反应生成溴苯和溴化氢,溴苯是密度大于水,无色的油状液体,溴化氢易挥发,能与水蒸气结合成氢溴酸液滴,溴化铁与氢氧化钠反应生成红褐色的氢氧化铁沉淀,
故答案为:NaOH溶液的底部有无色油珠产生,液面上产生白雾;(4)装置D和E导管口在液面上方,能防止倒吸,倒置漏斗增大了气体与氢氧化钠溶液的接触面积,有缓冲作用,能够防止倒吸,故答案为:DEF.
液溴和苯的混合物滴加到有铁粉的石棉绒上,液溴和苯在Fe作催化剂条件下能发生取代反应生成溴苯与HBr,溴和苯都是易挥发的物质,所以反应生成的溴苯及大部分未的反应苯和溴流入到下面的氢氧化钠溶液中,生成的溴化氢及挥发出的溴、苯通过C装置,苯和溴被吸收,溴化氢气体到D装置中能使石蕊变红,在E装置中溴化氢使硝酸银产生浅黄色沉淀,尾气用氢氧化钠吸收,由于溴化氢极易溶于水,所以F装置要用防止倒吸装置,(1)苯与液溴在催化剂作用下发生取代反应;(2)溴易挥发,易溶于有机溶剂,溴化氢溶于水电离产生氢离子和溴离子;(3)溴化铁与氢氧化钠反应生成氢氧化铁沉淀,溴苯密度大于水,是无水油状液体,溴化氢易挥发;(4)根据防倒吸的原理解答.


科目:高中化学 来源: 题型:
【题目】在100℃时,将0.200mol的四氧化二氮气体充入2L真空的密闭容器中,每隔一定的时间对该容器内的物质进行分析,得到如表格:
| 0 | 2 | 4 | 6 | 8 | 10 |
c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
试填空:
(1)该反应达到平衡时,四氧化二氮的转化率为%,表中c2c3、ab(填“>”、“<”或“=”).
(2)2min时四氧化二氮的浓度c1=mol/L,在0~2min时间段内,四氧化二氮的平均反应速率为mol/(Lmin).
(3)100℃时,该反应的平衡常数K=
(4)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性: ![]() >H2CO3>
>H2CO3> ![]() ,综合考虑反应物的转化率和原料成本等因素,将
,综合考虑反应物的转化率和原料成本等因素,将  转变为
转变为  的最佳方法是( )
的最佳方法是( )
A.与稀H2SO4共热后,加入足量的NaOH溶液
B.与稀H2SO4共热后,加入足量的NaHCO3溶液
C.与足量的NaOH溶液共热后,再通入足量CO2
D.与足量的NaOH溶液共热后,再加入适量H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在CuO和Zn粉的混合物中,加入一定量的稀硫酸,并微热,当反应停止后,滤出不溶物,并向滤液中插入一枚锌片,发现锌片并无任何变化。根据上述现象,确定下面结论正确的是
A. 不溶物一定是Cu B. 不溶物一定含Cu,但不一定含Zn
C. 不溶物一定是Zn D. 溶液中一定含有Zn2+,但不一定含有Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组欲测定某已部分变质的小苏打样品中Na2CO3的质量分数,设计如下实验方案。
【方案一】称取一定质量样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为_______________。
(2)实验中,需加热至恒重的目的是_______________。
【方案二】称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤、干燥沉淀,称量固体质量,计算。(已知:Ba2++OH-+HCO3-==BaCO3↓+H2O)
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为_______________。
(3)实验中判断沉淀是否完全的方法是_______________。
【方案三】按如下图所示装置进行实验:
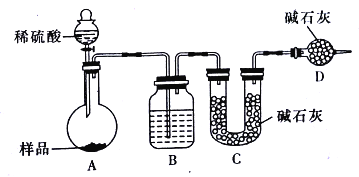
(1)D装置的作用是_______________。分液漏斗中_________(填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.90g样品,实验后测得C装置增重8.80g,则样品中Na2CO3的质量分数为________________(保留三位有效数字)
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存的在一个明显缺陷是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性溶液中能大量共存而且为无色透明的溶液是
A. NH4+、Al3+、SO42-、NO3- B. K+、Na+、NO3- 、SO32-
C. K+、 MnO4-、NH4+、NO3- D. Na+、K+、HCO3-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是生命物质的重要组成元素之一,含氮物质与人类的生活密切相关.
(1)氮原子最外层电子排布式为:;氮离子(N3﹣)核外有种运动状态不同的电子;N4分子的空间结构如图: ![]() ,它是一种分子.(填“极性”或“非极性”)
,它是一种分子.(填“极性”或“非极性”)
(2)氨气是人工固氮的产物,它极易溶于水(1:700),生成NH3H2O.请设计实验证明NH3H2O是弱碱 .
(3)向100mL 0.1mol/L的盐酸中通入0.02mol氨气,充分吸收后测得溶液呈碱性.则该溶液中NH3H2O、NH4+、Cl﹣三种微粒的物质的量浓度大小关系为 .
(4)铵盐可用作氮肥,实验室检验铵盐中的NH4+时,可取少量铵盐样品于试管中,加入强碱浓溶液,加热,若产生的气体能使 , 说明有NH4+ .
(5)NaN3可用于制造汽车安全气囊,当汽车遇到撞击时,NaN3能迅速分解产生Na和N2 . 请写出该反应的化学方程式 , 每生成3mol N2时,转移电子mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,某瓶充满O2时为116g,充满CO2时为122g,充满气体A时为114g,则A的式量为 ( )
A. 60 B. 32 C. 44 D. 28
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列化学反应的离子方程式的是( )
A. 铁片插入稀硫酸溶液中 Fe + 2H+ = Fe3+ + H2↑
B. 碳酸钙溶于足量盐酸中 CO32-+2H+=CO2+H2O
C. 石灰乳与硫酸溶液反应 H++OH-=H2O
D. 氧化钙与稀硝酸的反应 CaO+2H+ = Ca2++H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com