
【题目】能正确表示下列化学反应的离子方程式的是( )
A. 铁片插入稀硫酸溶液中 Fe + 2H+ = Fe3+ + H2↑
B. 碳酸钙溶于足量盐酸中 CO32-+2H+=CO2+H2O
C. 石灰乳与硫酸溶液反应 H++OH-=H2O
D. 氧化钙与稀硝酸的反应 CaO+2H+ = Ca2++H2O
科目:高中化学 来源: 题型:
【题目】图为苯和溴的取代反应的实验装置图,其中A为由具有支管的试管制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量铁屑粉. 
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应.写出A中所发生反应的化学方程式(有机物写结构简式): .
(2)试管C中苯的作用是 . 反应开始后,观察D和E两试管,看到的现象为 .
(3)反应2~3min后,在B中的NaOH溶液里可观察到的现象是 .
(4)在上述整套装置中,具有防倒吸作用的仪器有(填字母).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的单质及其化合物性质多样,用途广泛. 完成下列填空.
(1)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2:2NO+2CO ![]() 2CO2+N2+Q(Q>0) 某温度下测得该反应在不同时间的CO浓度如表:
2CO2+N2+Q(Q>0) 某温度下测得该反应在不同时间的CO浓度如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(CO) | 3.60×10﹣3 | 3.05×10﹣3 | 2.85×10﹣3 | 2.75×10﹣3 | 2.70×10﹣3 | 2.70×10﹣3 |
该反应平衡常数K的表达式为;温度升高,K值(选填“增大”、“减小”、“不变”);前2s内的平均反应速率v(N2)=;若上述反应在密闭容器中发生,达到平衡时能提高NO转化率的措施之一是 .
(2)工业合成氨的反应温度选择500℃左右的原因是 .
(3)实验室在固定容积的密闭容器中加入1mol氮气和3mol氢气模拟工业合成氨,反应在一定条件下已达到平衡的标志是 . a.N2、H2、NH3的浓度之比为1:3:2
b.容器内的压强保持不变
c.N2、H2、NH3的浓度不再发生变化
d.反应停止,正、逆反应的速率都等于零
(4)常温下向含1mol溶质的稀盐酸中缓缓通入1mol NH3(溶液体积变化忽略不计),反应结束后溶液中离子浓度由大到小的顺序是;在通入NH3的过程中溶液的导电能力(选填“变大”、“变小”、“几乎不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的相对分子质量为62.为进一步测定A 的化学式,现取3.1g A完全燃烧,得到二氧化碳和水蒸气.将产物先后通过足量的浓硫酸和碱石灰,两者分别增重2.7g和4.4g(假设每步反应完全).
(1)该有机物的实验式是;分子式是 .
(2)红外光谱显示有“C﹣C”键和“O﹣H”键的振动吸收,若核磁共振氢谱只有2个吸收峰且峰面积之比为1:2,推断该有机物的结构简式是 .
(3)该有机物与金属钠反应的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化银在水中存在溶解平衡:AgClAg++Cl﹣ . 在相同温度下,将足量氯化银分别放入相同体积的下列溶液中,Ag+的浓度最小的是( )
A.0.1mol/L HCl
B.蒸馏水
C.0.1mol/LAlCl3
D.0.1mol/LMgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某金属氯化物MCl2质量为m克,含有0.4molCl-,则金属M的摩尔质量可表示为( )
A. (m+71) g/mol B. 5m g/mol C. (5m-71) g/mol D. (5m-35.5) g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是 ( )
A. 电离时能产生的阳离子是氢离子的化合物一定是酸
B. 所有盐电离时一定产生酸根阴离子和金属阳离子
C. 酸性氧化物是指能与水反应生成酸的化合物,如CO2、SO3
D. 碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨氮废水中的氮元素多以NH4+和NH3H2O的形式存在.某工厂处理氨氮废水的流程如下: 含NH4+的废水 ![]() 低浓度氨氮废水
低浓度氨氮废水 ![]() 含余氯废水
含余氯废水 ![]() 达标废水
达标废水
(1)I中加入NaOH溶液,调pH=11并鼓入大量空气.用离子方程式表示加NaOH溶液的作用是;鼓入大量空气的目的是 .
(2)II中加入适量NaClO溶液,控制pH在6~7,将氨氮转化为无毒物质. ①为了完全从废水中去除氨氮,加入的NaClO与水体中NH4+的物质的量之比最小是 .
②过程 II发生3个反应:
i.ClO﹣+H+═HClO
ii.NH4++HClO═NH2Cl+H++H2O (NH2Cl中Cl元素为+1价)
iii. …
已知:水体中以+1价形式存在的氯元素有消毒杀菌的作用,被称为“余氯”.图为NaClO加入量与“余氯”含量的关系示意图.其中氨氮含量最低的点是c点.
b点表示的溶液中氮元素的主要存在形式是(用化学式表示);反应iii的化学方程式是 . 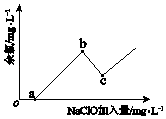
(3)III中用Na2SO3溶液处理含余氯废水,要求达标废水中剩余Na2SO3的含量小于5mgL﹣1 . 若含余氯废水中NaClO的含量是7.45mgL﹣1 , 则处理10m3含余氯废水,至多添加10% Na2SO3溶液kg(溶液体积变化忽略不计).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com