
����Ŀ�����ĵ��ʼ��仯�������ʶ�������;�㷺�� ���������գ�
��1����ѧ�������о����ô������������ٷɻ�β���е�NO��COת���CO2��N2��2NO+2CO ![]() 2CO2+N2+Q��Q��0�� ij�¶��²�ø÷�Ӧ�ڲ�ͬʱ���COŨ�������
2CO2+N2+Q��Q��0�� ij�¶��²�ø÷�Ӧ�ڲ�ͬʱ���COŨ�������
ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 | 5 |
c��CO�� | 3.60��10��3 | 3.05��10��3 | 2.85��10��3 | 2.75��10��3 | 2.70��10��3 | 2.70��10��3 |
�÷�Ӧƽ�ⳣ��K�ı���ʽΪ���¶����ߣ�Kֵ��ѡ���������С���������䡱����ǰ2s�ڵ�ƽ����Ӧ����v��N2��=����������Ӧ���ܱ������з������ﵽƽ��ʱ�����NOת���ʵĴ�ʩ֮һ�� ��
��2����ҵ�ϳɰ��ķ�Ӧ�¶�ѡ��500�����ҵ�ԭ���� ��
��3��ʵ�����ڹ̶��ݻ����ܱ������м���1mol������3mol����ģ�ҵ�ϳɰ�����Ӧ��һ���������Ѵﵽƽ��ı�־�� �� a��N2��H2��NH3��Ũ��֮��Ϊ1��3��2
b�������ڵ�ѹǿ���ֲ���
c��N2��H2��NH3��Ũ�Ȳ��ٷ����仯
d����Ӧֹͣ�������淴Ӧ�����ʶ�������
��4����������1mol���ʵ�ϡ�����л���ͨ��1mol NH3����Һ����仯���Բ��ƣ�����Ӧ��������Һ������Ũ���ɴ�С��˳��������ͨ��NH3�Ĺ�������Һ�ĵ���������ѡ��������С�������������䡱����
���𰸡�
��1��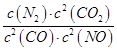 ����С��1.875��10��4mol/��L?s��������ѹǿ
����С��1.875��10��4mol/��L?s��������ѹǿ
��2��������500�����Ҿ�����ѻ���
��3��bc
��4��c��Cl��������NH4+����c��H+����c��OH��������������
���������⣺��1������ƽ�ⳣ������������Ũ�ȵ�ϵ������֮�����Է�ӦŨ��ϵ������֮��������K= ![]() ���÷�ӦΪ���ȷ�Ӧ���¶�ʱƽ�������ƶ�������ƽ�ⳣ����С��v��CO��=
���÷�ӦΪ���ȷ�Ӧ���¶�ʱƽ�������ƶ�������ƽ�ⳣ����С��v��CO��= ![]() =
= ![]() =3.75��10��4mol/l��v��N2��=
=3.75��10��4mol/l��v��N2��= ![]() =1.875��10��4mol/��Ls����һ��������ת���ʱ��˵��ƽ�������ƶ�����ͨ���ı�ѹǿ��ʹƽ�������ƶ����ʴ�Ϊ��
=1.875��10��4mol/��Ls����һ��������ת���ʱ��˵��ƽ�������ƶ�����ͨ���ı�ѹǿ��ʹƽ�������ƶ����ʴ�Ϊ�� ![]() ����С��1.875��10��4mol/��Ls��������ѹǿ����2����ҵ�ϳɰ��ķ�Ӧ�ǿ���ģ�ѡ��500�����ҵĽϸ��¶���ʹ��Ӧ������У������ڻ�ѧƽ��������ƶ���ʹ�ø��¶���Ҫ�ǿ��Ǵ����Ĵ�Ч���Լ���Ӧ���ʵ�֪ʶ���ʴ��Ϊ��������500�����Ҿ�����ѻ��ԣ���3��a��N2��H2��NH3��Ũ��֮��Ϊ1��3��2�������Dz��䣬�ʴ���
����С��1.875��10��4mol/��Ls��������ѹǿ����2����ҵ�ϳɰ��ķ�Ӧ�ǿ���ģ�ѡ��500�����ҵĽϸ��¶���ʹ��Ӧ������У������ڻ�ѧƽ��������ƶ���ʹ�ø��¶���Ҫ�ǿ��Ǵ����Ĵ�Ч���Լ���Ӧ���ʵ�֪ʶ���ʴ��Ϊ��������500�����Ҿ�����ѻ��ԣ���3��a��N2��H2��NH3��Ũ��֮��Ϊ1��3��2�������Dz��䣬�ʴ���
b�������ڵ�ѹǿ���ֲ��䣬˵����������ʵ������䣬��Ӧ��ƽ��״̬������ȷ��
c��N2��H2��NH3��Ũ�Ȳ��ٷ����仯��˵�����淴Ӧ������ȣ���Ӧ��ƽ��״̬������ȷ��
d����ѧƽ��״̬�Ƕ�̬ƽ�⣬��Ӧ������ֹͣ���ʴ���
��ѡ��bc����4������ǡ�÷�Ӧ�����Ȼ�泥���Һ�����ԣ���c��H+����c��OH������������Һ�ʵ������У�c��H+��+c��NH4+��=c��OH����+c��Cl��������Ϊc��H+����c��OH��������c��NH4+����c��Cl������������Ũ�ȴ�С��ϵΪ��c��Cl��������NH4+����c��H+����c��OH��������Һ������Ũ�ȼ������䣬���Ե��������������䣬�ʴ�Ϊ��c��Cl��������NH4+����c��H+����c��OH�������������䣮
��1������ƽ�ⳣ������������Ũ�ȵ�ϵ������֮�����Է�ӦŨ��ϵ������֮��дƽ�ⳣ���ı���ʽ�������¶ȶ�ƽ���ƶ���Ӱ���жϷ�Ӧ��ƽ�ⳣ���ı仯������v= ![]() �����м��㣻һ��������ת���ʱ��˵��ƽ�������ƶ�����2����ҵ�ϳɰ��ķ�Ӧ�ǿ���ģ�ѡ��500�����ҵĽϸ��¶���ʹ��Ӧ������У������ڻ�ѧƽ��������ƶ���ʹ�ø��¶���Ҫ�ǿ��Ǵ����Ĵ�Ч���Լ���Ӧ���ʵ�֪ʶ����3��ԭ�仯�����ֲ��䣬˵����ƽ��״̬����4����������1mol���ʵ�ϡ�����л���ͨ��1mol NH3����Һ����仯���Բ��ƣ��������Ȼ�泥���ǿ�������Σ�����Ũ�ȵĴ�СΪ��c��Cl������c��NH4+����c��H+����c��OH����������Ũ�ȼ������䣮
�����м��㣻һ��������ת���ʱ��˵��ƽ�������ƶ�����2����ҵ�ϳɰ��ķ�Ӧ�ǿ���ģ�ѡ��500�����ҵĽϸ��¶���ʹ��Ӧ������У������ڻ�ѧƽ��������ƶ���ʹ�ø��¶���Ҫ�ǿ��Ǵ����Ĵ�Ч���Լ���Ӧ���ʵ�֪ʶ����3��ԭ�仯�����ֲ��䣬˵����ƽ��״̬����4����������1mol���ʵ�ϡ�����л���ͨ��1mol NH3����Һ����仯���Բ��ƣ��������Ȼ�泥���ǿ�������Σ�����Ũ�ȵĴ�СΪ��c��Cl������c��NH4+����c��H+����c��OH����������Ũ�ȼ������䣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���ԣ� ![]() ��H2CO3��
��H2CO3�� ![]() ���ۺϿ��Ƿ�Ӧ���ת���ʺ�ԭ�ϳɱ������أ���
���ۺϿ��Ƿ�Ӧ���ת���ʺ�ԭ�ϳɱ������أ���  ת��Ϊ
ת��Ϊ  ����ѷ����ǣ� ��
����ѷ����ǣ� ��
A.��ϡH2SO4���Ⱥ���������NaOH��Һ
B.��ϡH2SO4���Ⱥ���������NaHCO3��Һ
C.��������NaOH��Һ���Ⱥ���ͨ������CO2
D.��������NaOH��Һ���Ⱥ��ټ�������H2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʵ���Ҫ���Ԫ��֮һ���������������������������أ�
��1����ԭ�����������Ų�ʽΪ���������ӣ�N3�������������˶�״̬��ͬ�ĵ��ӣ�N4���ӵĿռ�ṹ��ͼ�� ![]() ������һ�����ӣ�������ԡ��Ǽ��ԡ���
������һ�����ӣ�������ԡ��Ǽ��ԡ���
��2���������˹��̵��IJ������������ˮ��1��700��������NH3H2O�������ʵ��֤��NH3H2O������ ��
��3����100mL 0.1mol/L��������ͨ��0.02mol������������պ�����Һ�ʼ��ԣ������Һ��NH3H2O��NH4+��Cl�������������ʵ���Ũ�ȴ�С��ϵΪ ��
��4����ο��������ʣ�ʵ���Ҽ�������е�NH4+ʱ����ȡ���������Ʒ���Թ��У�����ǿ��Ũ��Һ�����ȣ���������������ʹ �� ˵����NH4+ ��
��5��NaN3����������������ȫ���ң�����������ײ��ʱ��NaN3��Ѹ�ٷֽ����Na��N2 �� ��д���÷�Ӧ�Ļ�ѧ����ʽ �� ÿ����3mol N2ʱ��ת�Ƶ���mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬ��ͬѹ�£�ijƿ����O2ʱΪ116g������CO2ʱΪ122g����������AʱΪ114g����A��ʽ��Ϊ ( )
A. 60 B. 32 C. 44 D. 28
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ϩ��������ԭ�Ϻϳɻ�״������E�����ڷ�����������ʵĻ�����Ľṹ��ʽ����д��A��E��ˮ�ⷽ��ʽ�� 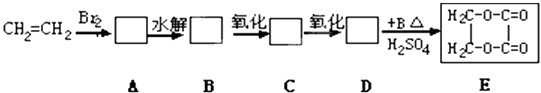
��1���ṹ��ʽABCD
��2��Aˮ�ⷽ��ʽ��Eˮ�ⷽ��ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������±������ķ���ʽ���У��жϿո�������ͬ���칹����Ŀ�ǣ� ��
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
CH4 | C2H4 | C3H8 | C4H8 | C6H12 | C7H16 | C8H16 |
A.3
B.4
C.5
D.6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B�����л�����ɵĻ����������������һ��ʱ������A��B�Ժ��ֱ�����ϣ���ȫȼ�պ�����CO2������Ϊ��ֵ���������һ�������л�������ǣ� ��
A.�״���CH3OH�����Ҷ�����HOCH2CH2OH��
B.��ȩ��HCHO������ȩ ��CH3CHO��
C.CH4�� 
D.����C6H6���ͱ��ӣ�C6H5OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȷ��ʾ���л�ѧ��Ӧ�����ӷ���ʽ���ǣ� ��
A. ��Ƭ����ϡ������Һ�� Fe + 2H+ = Fe3+ + H2��
B. ̼����������������� CO32-��2H+��CO2��H2O
C. ʯ������������Һ��Ӧ H++OH-=H2O
D. ��������ϡ����ķ�Ӧ CaO��2H+ �� Ca2++H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʵ���Ũ��֮��Ϊ3:2:1��NaCl��MgCl2��AlCl3������Һ�������ǵ������ͬʱ��������Һ��Cl-���ӵ����ʵ���Ũ��֮���ǣ� ��
A.3��4��3B.1��2��3C.3��2��1D.1��1��1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com