
【题目】阿伏加德罗常数的近似值为6.02×1023。按要求完成下列填空:
(1)1molCl2中约含有___个氯气分子,约含有__个氯原子。含有6.02×1023个氢原子的H2SO4的物质的量是___;
(2)某硫酸钠溶液中含有3.01×1023个Na+,则该溶液中SO42-的物质的量是___。
(3)2L1mol/LMgCl2中镁离子的物质的量为___,Cl-的物质的量浓度为___。
(4)三种盐的混合溶液中含有0.2molNa+、0.25molMg2+、0.4molCl-、SO42-,则SO42-的微粒个数约为___。
【答案】NA 2NA 0.5mol 0.25mol 2mol 2mol/L 0.15NA
【解析】
(1)根据n=![]() ,结合分子的构成计算;
,结合分子的构成计算;
(2)根据n=![]() 计算n(Na+),由化学式可知n(SO42-)=
计算n(Na+),由化学式可知n(SO42-)=![]() n(Na+);
n(Na+);
(3)根据c=![]() 结合物质的分子式来计算;
结合物质的分子式来计算;
(4)溶液中阴离子和阳离子的正负电荷守恒,根据守恒思想来计算。
(1)根据n=![]() ,1molCl2中含有NA个氯气分子,含有2NA个氯原子,含有6.02×1023个氢原子的H2SO4的个数为
,1molCl2中含有NA个氯气分子,含有2NA个氯原子,含有6.02×1023个氢原子的H2SO4的个数为![]() ×6.02×1023,H2SO4的物质的量是0.5mol;
×6.02×1023,H2SO4的物质的量是0.5mol;
(2)n(Na+)=![]() =0.5mol,由化学式可知n(SO42-)=
=0.5mol,由化学式可知n(SO42-)=![]() n(Na+)=0.5mol×
n(Na+)=0.5mol×![]() =0.25mol;
=0.25mol;
(5)2L 1mol/LMgCl2中镁离子的物质的量为2L×1mol/L=2mol,Cl-的物质的量浓度为2mol/L;
(6)溶液中阴离子和阳离子的正负电荷守恒,即n(Na+)+2n( Mg2+)=n (Cl-)+2n(SO42-),所以0.2 mol+2×0.25 mol=0.4 mol+2n(SO42-),解出n(SO42-)=0.15mol,则SO42-的微粒个数为0.15NA。


科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O,相对分子质量为180)呈淡黄色,可用作照相显影剂。某实验小组对其进行了一系列探究。
I.纯净草酸亚铁晶体热分解产物的探究。
(1)气体产物成分的探究。小组成员采用如下装置(可重复选用)进行实验:

①装置D的名称为___________。
②按照气流从左到右的方向,上述装置的连接顺序为___________→尾气处理装置(填仪器接口的字母编号)。
③实验前先通入一段时间N2,其目的为______________________。
④实验证明了气体产物中含有CO,依据的实验现象为______________________。
(2)固体产物成分的探究。充分反应后,A处反应管中残留黑色固体。查阅资料可知,黑色固体可能为Fe或FeO。小组成员设计实验证明了其成分只有FeO,其操作及现象为___________。
(3)依据(1)和(2)结论,可知A处反应管中发生反应的化学方程式为___________。
Ⅱ.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取m g草酸亚铁晶体样品并溶于稀H2SO4中,配成250mL溶液。
步骤2:取上述溶液25.00mL,用c mol· L -1KMnO4标准液滴定至终点,消耗标准液V1mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用cmol·L-1KMnO4标准溶液滴定至终点,消耗标准液V2mL。
(4)步骤3中加入锌粉的目的为____________________________________________。
(5)草酸亚铁晶体样品的纯度为____________________________________________;若步骤1配制溶液时部分Fe2+被氧化,则测定结果将___________(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到实验目的的是( )

A. 形成锌-铜原电池 B. 实验室制备乙酸乙酯
C. 证明酸性:CHCOOH>H2CO3>硅酸 D. 石油的分馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O(g)的物质的量随混合烃的总物质的量的变化如图所示。则该产物混合气体的平均摩尔质量为___________g· mol-1(保留3位有效数字),该混合烃的平均分子式为________________。
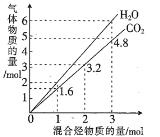
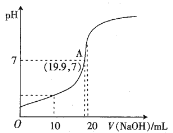
(2)常温下,向20 mL 0.10 mol·L-1HB溶液中逐滴滴入0.10 mol·L-1 NaOH溶液,所得pH曲线如下图所示。则HB是_______酸(填“强”或“弱”),A点对应的溶液中![]() 为_______。
为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是
A.氯气通入水中,溶液呈酸性:Cl2 + H2O ![]() 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
B.向氯化铝溶液中加入过量氨水: Al3+ + 4OH-=AlO2-+ 2H2O
C.碳酸氢铵溶液中加足量的氢氧化钠溶液:NH4+ + OH- = NH3↑ + H2O
D.二氧化硫通入溴水中,溴水褪色:SO2 + Br2 + 2H2O = 4H+ + 2Br- + SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,生成物所贮的化学能比反应物所贮化学能要多的是( )
A.CaO+H2O=Ca(OH)2
B.NaOH+HCl=NaCl+H2O
C.CH4+2O2 ![]() CO2+2H2O
CO2+2H2O
D.CO2+C ![]() 2CO
2CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铂电极电解100mLHNO3 与AgNO3 的混合液,通电一段时间后,两极均收集到4.48L气体(标准状况),则原混合液中Ag+的物质的量浓度为( )
A. 1mol·L-1B. 2mol·L-1C. 2.5mol·L-1D. 4mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
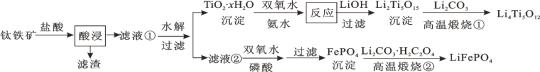
下列说法不正确的是
A.“酸浸”后,若钛主要以TiOCl42-形式存在,则相应反应的离子方程式可表示为:FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O
B.若Li2Ti5O15中Ti的化合价为+4,则其中过氧键的数目为3个
C.“高温煅烧②”中由FePO4制备LiFePO4的化学方程式可表示为:2FePO4+Li2CO3+H2C2O4![]() 2LiFeO4+H2O↑+3CO2↑
2LiFeO4+H2O↑+3CO2↑
D.TiO2·xH2O沉淀与双氧水、氨水反应40min所得实验结果如表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率/% | 92 | 95 | 97 | 93 | 88 |
可知,40℃前,未达到平衡状态,随着温度升高,转化率变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求计算。
(1)0.5mol NaAlO2含有___mol Na+;_____mol AlO2-;含___个O。
(2)在100 mL 0.2 mol/L NaOH溶液中含溶质的物质的量___mol;配制50 mL 0.2 mol/LFeSO4溶液,需要FeSO4____ g。
(3)1.06 g的Na2CO3的物质的量是___mol;含有的CO32-离子数是___个。
(4)标准状况下,0.3 mol CH4的体积是___;含有碳原子质量是___;含有氢原子物质的量_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com