
【题目】下列物质见光不会分解的是( )
A. HNO3 B. AgNO3 C. HClO D. NaHCO3
科目:高中化学 来源: 题型:
【题目】2008年诺贝尔化学奖授予美籍华裔钱永健等三位科学家,以表彰他们发现和研究了绿色荧光蛋白。荧光素是发光物质的基质, 5-羧基荧光素与5-羧基二乙酸荧光素在碱性条件下有强烈的绿色荧光,它们广泛应用于荧光分析等。

![]()
下列说法不正确的是
A. 5-FAM转变为5-CFDA属于取代反应
B. 5-FAM的分子式为C21H12O7
C. 5-FAM和5-CFDA 各1mol分别与足量NaOH溶液反应,消耗NaOH 物质的量相同
D. 实验室鉴别5-FAM与5-CFDA可用NaHCO3 溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于物理变化的是( )
①石油的分馏 ②煤的干馏 ③石油的裂化 ④铝热反应 ⑤由乙烯制备聚乙烯
⑥将氧气转化为臭氧 ⑦乙烯催熟果实 ⑧蛋白质的盐析 ⑨海水蒸馏制取淡水
A.①②③④B.①②⑤⑦
C.①⑧⑨D.①②⑥⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验探究是化学学科的重要特征。
Ⅰ.根据下列装置图,回答有关问题:
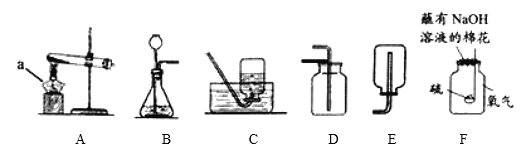
(1)a仪器的名称是________。
(2)如用装置A制取氧气,其反应的化学方程式为_______________________________;如用装置B制取氧气,往长颈漏斗中倒入的液体药品是__________;如用装置D收集氧气,则验满的方法是_____________________________。
(3)小明用装置F做硫在氧气中燃烧的实验,该改进实验最大优点是________________。
Ⅱ.粗盐提纯中得到的“精盐”常还含有可溶性杂质(假设只有CaCl2一种),为得到更纯净的氯化钠,同学们做了如下处理:
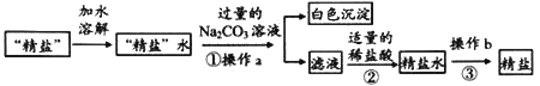
(1)操作b的名称是_________。
(2)步骤①加入过量的Na2CO3溶液的目的是________________。
(3)步骤②反应的化学方程式:___________________________。
(4)如何证明经过步骤②后过量的Na2CO3已除尽?_________________________(写出实验操作、现象、结论)。
(5)若不考虑损耗,经过上述处理得到的精盐质量_______(填“大于”、“小于”或“等于”)原“精盐”质量,原因是__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
降凝剂是指能降低润滑油凝固点的化学品,一般是高分子有机化合物,降凝剂I是两种物质加聚得到的高分子化合物,通常加入油品中以降低凝固点,扩大燃料油品的使用范围,为合成得到降凝剂I,设计了以烯烃A为起始原料的合成路线:

试写出:
(1) A的名称:________________,B→C的反应条件:____________________。
F中含有的官能团名称:______________________。
(2) E可以在一定条件下合成高聚物J,写出反应的化学方程式:_______________________。
(3) H是一种核磁共振氢谱一组峰的五元环状结构,写出降凝剂I的结构简式:____________。
(4) F有多种同分异构体,其中①能与NaOH溶液反应但不能与NaHCO3溶液反应②能使溴水褪色的同分异构体有______种(不考虑顺反异构),写出其中核磁共振氢谱峰面积之为1∶1∶2∶2与NaOH溶液反应的化学方程式:____________________________________。
(5) 请结合合成路线写出由苯乙醇、乙醇为原料合成 的最合理方案。___________________ (其他无机试剂任选)
的最合理方案。___________________ (其他无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中,能使水的电离平衡向右移动且使液体呈酸性的是
A. 向水中加入NaHSO4 B. 向水中加入CuSO4
C. 向水中加入Na2CO3 D. 将水加热到100℃,使pH=6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应:2FeCl3 + 2KI = 2FeCl2 + 2KCl + I2;2FeCl2 + Cl2 = 2FeCl3。判断下列物质的氧化性由强到弱的顺序是( )
A.Cl2>Fe3+>I2 B.Fe3+>Cl2>I2 C.Fe3+>I2>Cl2 D. Cl2>I2> Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定温度下,将2 mol SO2和1mol O2充入10 L恒容密闭容器中,发生反应2SO2(g) +O2(g)![]() 2SO3(g) △H =-196 kJ mol-1。5 min时达到平衡,测得反应放热166. 6 kJ。下列说法错误的是
2SO3(g) △H =-196 kJ mol-1。5 min时达到平衡,测得反应放热166. 6 kJ。下列说法错误的是
A. 0~5 min内,用O2表示的平均反应速率V(O2)=0.017 mol·L-1·min-1
B. ![]() 的值不变时,该反应达到平衡状态
的值不变时,该反应达到平衡状态
C. 若增大O2的浓度,SO2的转化率增大
D. 条件不变,若起始时充入4 mol SO2和2 mol O2,平衡时放出的热量小于333.2 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液的pH=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是
A. 1∶9 B. 1∶1 C. 1∶2 D. 1∶4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com