
【题目】二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。

(1)科学家提出由CO2制取C的太阳能工艺如上图所示。
①若“重整系统”发生的反应中![]() =6,则FexOy的化学式为________。
=6,则FexOy的化学式为________。
②“热分解系统”中每分解1molFexOy,转移电子的物质的量为________。
工业上用CO2和H2反应合成甲醚。已知:
CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1
CH3OCH3(g)+H2O(g)===2CH3OH(g) ΔH2=+23.4kJ·mol-1
则2CO2(g)+6H2(g)===CH3OCH3(g)+3H2O(g) ΔH3=________kJ·mol-1。
①一定条件下,上述合成甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是________(填字母)。
a.逆反应速率先增大后减小 b.H2的转化率增大
c.反应物的体积百分含量减小 d.容器中的![]() 值变小
值变小
②在某压强下,合成甲醚的反应在不同温度、不同投料比时,CO2的转化率如下图所示。T1温度下,将6molCO2和12molH2充入2L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=__________;KA、KB、KC三者之间的大小关系为____________。

(3)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中,c(NH![]() )________(填“>”、“<”或“=”)c(HCO
)________(填“>”、“<”或“=”)c(HCO![]() );反应NH
);反应NH![]() +HCO
+HCO![]() +H2O=NH3·H2O+H2CO3的平衡常数K=__________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11)
+H2O=NH3·H2O+H2CO3的平衡常数K=__________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11)
【答案】 Fe3O4 2mol -130.8 b 0.18mol·L-1·min-1 KA=KC>KB > 1.25×10-3
【解析】(1)①由示意图可知,重整系统中CO2和FeO反应生成FexOy和C,发生的反应中n(FeO)/
n(CO2) =6,根据Fe原子、O原子守恒可知x:y=6:(6+2)=3:4,故FexOy的化学式为Fe3O4;②“热分解系统”中分解的方程式为2Fe3O4=6FeO+O2↑,每分解1molFe3O4生成0.5mol氧气,转移电子的物质的量为0.5mol×4=2mol;已知:①CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1,②CH3OCH3(g)+H2O(g)===2CH3OH(g) ΔH2=+23.4kJ·mol-1,根据盖斯定律,①×2-②可得:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g) ΔH3=-130.8kJ·mol-1。(2)①a.逆反应速率先增大后减小,可能是增大生成物浓度,平衡逆向移动,错误;b.氢气的转化率增大,平衡一定正向移动,正确;c.反应物的体积百分含量减小,可能是增大生成物浓度,平衡逆向移动,错误;d.容器中的n(CO2)/n(H2)变小,可能是减小二氧化碳物质的量,平衡逆向移动,错误;答案选b。②T1温度下,将6molCO2和12molH2充入2L的密闭容器中,由图象可知,5min后反应达到平衡状态时二氧化碳转化率为60%,则生成CH3OCH3为6mol×60%×1/2=1.8mol,所以平均反应速率v(CH3OCH3)=1.8mol÷(2L×
5min) =0.18molL-1min-1;③反应为放热反应,升高温度平衡向逆反应方向进行,转化率降低,因此T1<T2,而平衡常数只与温度有关系,则KA、KB、KC三者之间的大小关系为KA=KC>KB ;(3)根据盐类水解规律,已知NH3·H2O的电离平衡常数K=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11,所以碳酸氢根的水解程度更大,因此c(NH4+) >c(HCO3-);反应NH4++HCO3-+H2O=NH3·H2O+H2CO3的平衡常数K=c(NH3H2O)c(H2CO3) /
c(NH4+)c(HCO3)=c(H+)c(OH)/K(NH3H2O)K1 =![]() =1.25×10-3。
=1.25×10-3。


科目:高中化学 来源: 题型:
【题目】下列实验不能达到实验目的或者实验操作不正确的是
A. 定容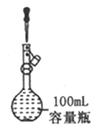
B. 比较硫、碳、硅三种元素
C. 处理尾气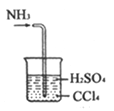
D. 测定黄铜(Cu、Zn素的非金属性强弱合金)中Zn的含量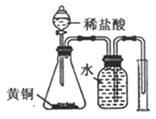
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某l00mL溶液可能含有Na+、NH4+、Fe3+、CO32 -、SO42 -、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( )

A. 原溶液一定存在CO32 -和SO42 -,一定不存在Fe3+
B. 是否存在Na+只有通过焰色反应才能确定
C. 原溶液一定存在Na+,可能存在Cl-
D. 若原溶液中不存在Cl-,则c (Na+) =0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芦笋中的天冬酰胺(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效。

(1)天冬酰胺所含元素中,________(填元素名称,下同)元素基态原子核外未成对电子数最多,第一电离能最大的是________。
(2)天冬酰胺中碳原子的杂化轨道类型为________,分子中σ键和π键数目之比为________。
(3)O、S、Se为同主族元素,H2O、H2S和H2Se的参数对比见表。
化学式 | 键长/nm | 键角 |
H2O | 0.99 | 104.5° |
H2S | 1.34 | 92.3° |
H2Se | 1.47 | 91.0° |
H2S的键角大于H2Se的原因可能为________________________________________。
H2O、H2S、H2Se沸点由高到低的顺序为________________,酸性由强到弱的顺序为________________。
(4)写出铬的基态原子电子排布式:________________________________________。
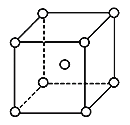
(5)铬为体心立方晶体,晶胞结构如图,则该晶胞中含有______个铬原子。若铬的密度为ρg·cm-3,相对原子质量为M,NA表示阿伏加德罗常数的值,则铬原子的半径为______cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氢、氧3种元素组成的有机物A,相对分子质量为102,含氢的质量分数为9.8%,分子中氢原子个数为氧的5倍。一定条件下,A与氢气反应生成B,B分子的结构可视为1个碳原子上连接2个甲基和另外2个结构相同的基团。且B的核磁共振氢谱显示有3组不同的峰。
(1)A的分子式是 。
(2)下列物质与A以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量相等且生成水的量也相等的是(填序号) 。
A.C5H12O3 B.C4H10 C.C6H10O4 D.C5H10O
(3)①B的结构简式是 。②A不能发生的反应是(填序号) 。
A.取代反应 B.消去反应 C.酯化反应 D.还原反应
(4)A还有另一类酯类同分异构体,该异构体在酸性条件下水解,生成两种相对分子质量相同的化合物,其中一种的分子中有2个甲基,该异构体的结构简式是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于常温下pH=2的醋酸溶液的叙述正确的是
A. c(CH3COOH)=0.01 mol·L-1
B. c(H+)=c(CH3COO-)
C. 加水稀释100倍后,pH=4
D. 加入醋酸钠固体,可抑制醋酸的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.漂白粉在空气中不稳定,可利用其不稳定性用于漂白纸张
B.Mg在空气中燃烧时发出耀眼的白光,可用于制造信号弹
C.氧化钠能与H2O、CO2反应,可用作漂白剂和供氧剂
D.常温时浓硝酸与铁不反应,可用铁桶贮存浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应从0—2分钟进行过程中, 在不同反应时间各物质的量的变化情况如右图所示:
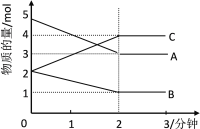
(1)则该反应的的反应物是_______,生成物是________,化学方程式为_________。
(2)反应开始至2分钟时,能否用浓度表示反应速率?若能,其反应速率为_______________,若不能,则其原因为_____________________________________。
(3)2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了____________状态。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com