
【题目】化学反应速率、限度及能量与生产、生活密切相关。
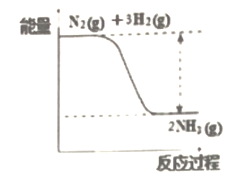
(1)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2+3H2![]() 2NH3。合成氨反应中的能量变化如图所示,该反应中,反应物化学键断裂吸收的总能量___(填“大于”或“小于”)生成物化学键形成放出的总能量。
2NH3。合成氨反应中的能量变化如图所示,该反应中,反应物化学键断裂吸收的总能量___(填“大于”或“小于”)生成物化学键形成放出的总能量。
(2)小王同学为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 50 | 190 | 414 | 526 | 570 |
①求2~4分钟时间段以盐酸的浓度变化来表示的该反应速率___。(设溶液体积不变)
②小蒋同学认为在盐酸溶液中滴入少量的CuSO4溶液可以加快反应的速率,请从电化学的角度给子构成的原电池中负极反应式为___;溶液中H+移向___极(填“正“或“负")。
(3)某温度下在4L恒容密闭容器中,3种气态物质X、Y、Z的物质的量随时间变化曲线如图。
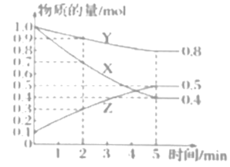
①写出该反应的化学方程式___。
②在5min时,该反应达到了平衡状态,下列可作为判断反应已达到该状态的是___。
A.X、Y、Z的浓度相等
B.容器内气体压强保持不变
C.X、Y的反应速率比为3:1
D.生成1molY的同时生成2molZ
③该反应达平衡时,X的转化率为___。
【答案】小于 0.075mol·L-1·min-1 Zn-2e-=Zn2+ 正 3X+Y![]() 2Z BD 60%
2Z BD 60%
【解析】
根据图像判断反应放热还是吸热,进而判断断键吸收的能量和成键放出的能量大小关系,根据公式![]() 计算化学反应速率,根据原电池原理书写电极反应式并判断离子移向,结合图示信息得出反应物、生成物,并由化学计量数之比等于转化的物质的量书写化学方程式,判断条件是否为变量从而判断反应是否达到平衡。
计算化学反应速率,根据原电池原理书写电极反应式并判断离子移向,结合图示信息得出反应物、生成物,并由化学计量数之比等于转化的物质的量书写化学方程式,判断条件是否为变量从而判断反应是否达到平衡。
(1)由合成氨反应中的能量变化图可知,该反应为放热反应,则反应物化学键断裂吸收的总能量小于生成物化学键形成放出的总能量;
(2)①锌与盐酸反应的化学方程式为Zn+2HCl=ZnCl2+H2↑,由表格数据可知2~4分钟时间段内氢气的变化量为526mL-190mL=336mL=0.336L,则![]() ,所以
,所以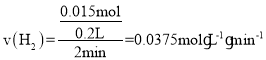 ,根据化学反应速率之比等于化学计量数之比可得
,根据化学反应速率之比等于化学计量数之比可得![]() ;
;
②在盐酸溶液中滴入少量的CuSO4溶液,可形成铜锌原电池,其中锌作负极失去电子,电极反应式为Zn-2e-=Zn2+,原电池中阳离子向正极移动,即溶液中H+向正极移动;
(3)①根据图像可知,X、Y为反应物,Z为生成物,且转化的物质的量之比为3:1:2,则该反应的化学方程式为3X+Y![]() 2Z;
2Z;
②A. 在5min时,该反应达到了平衡状态,此时X、Y、Z的浓度不相等,因此X、Y、Z浓度相等,不能说明反应达到平衡,A不选;
B.该反应为前后气体体积变化的反应,压强不变时,可以说明反应达到平衡,B选;
C.无论是否达到平衡,化学反应速率之比始终等于化学计量数之比,所以X、Y的反应速率比为3:1不能说明反应达到平衡,C不选;
D.生成1molY的同时生成2molZ,正逆反应速率相等,可以说明反应达到平衡,D选;
故答案选BD;
③由图像可知,5min达到平衡时X转化了0.6mol,则X的转化率=![]() 。
。


科目:高中化学 来源: 题型:
【题目】控制适合的条件,将反应2Fe3++2I-![]() 2Fe2++I2设计成如图所示的原电池。下列判断不正确的是( )
2Fe2++I2设计成如图所示的原电池。下列判断不正确的是( )
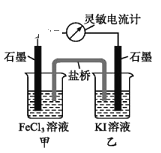
A.反应开始时,乙中石墨电极上发生氧化反应
B.电流计读数为零时,反应达到化学平衡状态
C.电流计读数为零后,在甲中加入FeCl2固体,乙中石墨电极为正极
D.盐桥中装有含琼胶的氯化钾饱和溶液,其作用是传递电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某微生物电解池(MEC)制氢工作原理如右图所示。用该电解池电解0.1mol·L-1的CH3COOH溶液,下列说法正确的是
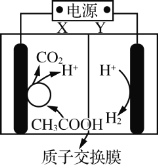
A.Y为电源的正极
B.该电解装置中,阳极的电极反应式为:CH3COOH+2H2O+8e-= 2CO2↑+8H+
C.当2mol H+通过质子交换膜时,则标准状况下产生22.4L H2
D.电解一段时间后,溶液中![]() 的值变小
的值变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:(均在常温下)其归纳正确的是( )
①反应2A (s)+B (g)=2C (g)+D (g)不能自发进行,则该反应△H一定大于0
②pH=2的盐酸和pH=1的盐酸,c(H+)之比为2∶1。
③pH相等的三种溶液:a.CH3COONa b.NaHCO3 c.NaOH,其溶质物质的量浓度由小到大顺序为:c、b、a
④常温下,pH=1的强酸溶液,加水稀释后,溶液中所有离子浓度均降低。
⑤在等物质的量浓度、等体积的氯化铵和氨水的混合溶液中存在下列关系:c(NH4+)+2c(H+)=2c(OH-)+c(NH3·H2O)
⑥反应A(g)![]() 2B(g)△H,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则 △H =(Ea -Eb)kJ·mol-1。
2B(g)△H,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则 △H =(Ea -Eb)kJ·mol-1。
A. 全部 B. ②④⑤⑥ C. ①③④⑥ D. ①③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用如图所示的装置实现“路线图”中的部分转化,下列叙述错误的是( )
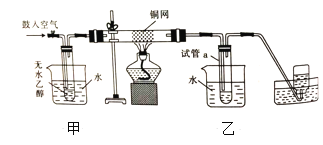
A. 铜网表面乙醇发生氧化反应
B. 甲、乙烧杯中的水均起冷却作用
C. 试管a收集的液体中至少有两种有机物
D. 实验开始后熄灭酒精灯,铜网仍能红热,说明发生的是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物G可用来制备抗凝血药,可通过下列路线合成。
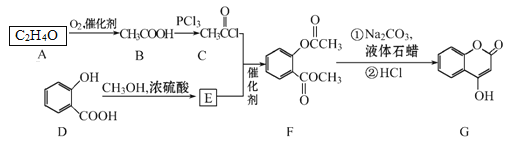
请回答:
(1)C+E→F的反应类型是____。
(2)F中含有的官能团名称为____。
(3)在A→B的反应中,检验A是否反应完全的试剂为_____。
(4)写出G和过量NaOH溶液共热时反应的化学方程式_____。
(5)化合物E的同分异构体很多,符合下列条件的结构共____种。
①能与氯化铁溶液发生显色;②能发生银镜反应;③能发生水解反应
其中,核磁共振氢谱为5组峰,且峰面积比为2∶2∶2∶1∶1的结构简式为___。
(6)E的同分异构体很多,所有同分异构体在下列某种表征仪器中显示的信号(或数据)完全相同,该仪器是___(填标号)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
(7)已知酚羟基一般不易直接与羧酸酯化。苯甲酸苯酚酯(![]() )是一种重要的有机合成中间体。请根据已有知识并结合相关信息,试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任选)。____
)是一种重要的有机合成中间体。请根据已有知识并结合相关信息,试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任选)。____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池可净化废水,同时还能获得能源或有价值的化学产品,图1为其工作原理,图2为废水中Cr2O72-离子浓度与去除率的关系。下列说法正确的是

A. M为电池正极,CH3COOH被还原
B. 外电路转移4mol电子时,M 极产生22.4LCO2
C. 反应一段时间后,N极附近的溶液pH下降
D. Cr2O72-离子浓度较大时,可能会造成还原菌失活
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应4A(s) + 3B(g)![]() 2C(g) + D(g),经2min,B的浓度减小了0.6mol/L,对此反应速率的表示正确的是( )
2C(g) + D(g),经2min,B的浓度减小了0.6mol/L,对此反应速率的表示正确的是( )
A.用A表示的反应速率是0.4mol/(L·min)
B.升高温度,正反应速率增大,逆反应速率减小
C.2min末的反应速率用B表示为0.3 mol/(L·min)
D.用v(B)、v(C)表示B、C的反应速率:则3 v(C) = 2 v(B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 H2CO3 ![]() HCO3-+H+ K1=4.3×10-7 HCO3
HCO3-+H+ K1=4.3×10-7 HCO3 ![]() CO32-+H+ K2=5.6×10-11
CO32-+H+ K2=5.6×10-11
HClO ![]() ClO-+H+ K=3.0×10-8
ClO-+H+ K=3.0×10-8
H2SO3 ![]() HSO3-+H+ K1=1.54×10-2 HSO3-
HSO3-+H+ K1=1.54×10-2 HSO3- ![]() SO32-+H+ K2=1.02×10-11
SO32-+H+ K2=1.02×10-11
根据电离平衡常数分析,下列各式中正确的是
A.少量CO2通入NaClO溶液中:CO2+H2O+2ClO=CO32-+2HClO
B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO═CaSO3↓+2HClO
C.空气中CO2和水蒸气与Ca(ClO)2溶液反应:Ca2++2ClO+CO2+H2O═CaCO3↓+2HClO
D.相同浓度NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-═CO2↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com