
【题目】乙醇分子中不同的化学键如右图,关于其在各类反应中断裂键的说明不正确的是
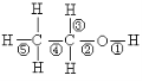
A. 和金属钠反应键①断裂
B. 和HBr在一定条件下反应时键②断裂
C. 和浓硫酸共热140℃时键①或键②断裂;170℃时键②③断裂
D. 在Ag催化下和O2反应键①③断裂
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】Na2O2是重要的化工原料,具有多种用途。
(1)写出CO2和Na2O2反应的化学方程式:___________________________________。
(2)某学生判断SO2和Na2O2反应能生成硫酸钠,你认为他的判断合理吗?__________,简要说明理由:_______________________________________________。
(3)该同学无法断定反应中是否有氧气生成,拟使用如图所示装置进行实验(图中铁架台等装置已略去)。
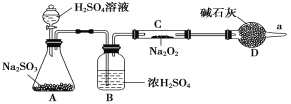
装置中B的作用是_________________,D的作用是_____________________。
(4)将足量的Na2O2投入到含有下列离子的溶液中:NO3-、S2-、HCO3-、CO32-、Na+,设反应完毕后,无固体析出,则上述离子数目减少的有__________,数目增多的离子有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镓(Ga)与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物。工业制备镓的流程如图所示:
![]()
下列判断不合理的是( )
A. Al、Ga均处于ⅢA族B. Ga2O3可与盐酸反应生成GaCl3
C. 酸性:Al(OH)3>Ga(OH)3D. Ga(OH)3可与NaOH反应生成NaGaO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示。A是常见的无色液体,B是海水中最多的盐,D、F、J均为气体,C是石灰乳,L是石灰石,M具有漂白性,G、K均具有磁性,其中K为常见的金属单质。
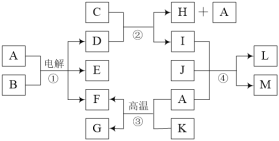
(1)E的化学式为____。
(2)A的电子式为____。
(3)写出反应③的化学方程式:____。
(4)写出反应④的离子方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)以下为中学化学中常见的几种物质:①二氧化碳②熔融KC1③NaHSO4固体④铜⑤稀硫酸⑥蔗糖⑦澄清石灰水,其中属于电解质的有_____________,属于非电解质的有__________________(填编号)。
(2)高铁酸钠(Na2FeO4)(铁为+6价)是一种新型的净水剂,可以通过下述反应制取:2Fe(OH)3+4NaOH+3NaC1O=2Na2FeO4+3NaCl+5H2O
①该反应中氧化剂是_____________(用化学式表示,后同),_____________元素被氧化,还原产物为_____________;
②当反应中有1molNaFeO4生成,转移的电子有_____________ mol;
③用单线桥法标出反应中电子转移的方向和数目。________
(3)配平该反应方程式:
______K2Cr2O7+______HCl═______KCl+______CrCl3+______Cl2↑+______H2O,
(4)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)现有四种有机物:①乙烯,②2-丙醇,③甲苯,④![]() ,⑤
,⑤![]() ,⑥
,⑥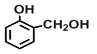 ,⑦
,⑦![]() ,⑧
,⑧![]() 其中:
其中:
(1)能衡量一个国家的石油化工生产水平的是__________(填序号),该物质可用于制备常用塑料,其反应化学方程式是_______________________。
(2)能用来制取梯恩梯(TNT)的是________(填序号),其发生反应的化学方程式是__________________;
(3)上述有机物能与金属钠发生反应的是_________(填序号),与⑧互为同分异构体的是___________(填序号),⑤与酸性高锰酸钾反应的产物是______________(填结构简式);
(二)实验室用燃烧法测定某固体有机物A的分子组成,测定装置如图所示(铁架台、铁夹、酒精灯等未画出):
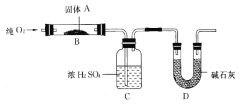
取17.1g A放入B装置中,持续通入过量O2燃烧,生成CO2和H2O,请回答下列有关问题:
(4)D装置的作用是____________________,有同学认为该套装置有明显的缺陷,需要改进,该同学判断的理由是___________________;
(5)装置改进后进行实验,若A的摩尔质量为342g/mol,C装置增重9.9g,D装置增重26.4 g,则A的分子式为_____________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
(1)在如图所示仪器中,配制上述溶液肯定不需要的是_____(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是____。
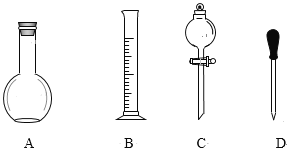
(2)在容量瓶的使用方法中,下列操作不正确的是____(多选题)。
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中。
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(3)根据计算用托盘天平称取的NaOH质量为___g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度___0.1mol/L(填“大于”“小于”或“等于”)。
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为__mL,如果实验室有10mL、20mL、50mL量筒,应选用___mL量筒最好。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有pH=2的HX溶液和HY溶液各1mL ,分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法正确的是
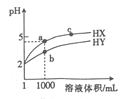
A. a、c两点对应HX的电离平衡常数:K(c)>K(a)
B. a、b两点对应的溶液中:c(X-)>c(Y-)
C. 等物质的量浓度的NaX和NaY的混合溶液中:c(HY)>c(HX)
D. 分别向10mL0.1mol/LHX溶液和10mL 0.1mol/L HY溶液中滴加同浓度的氢氧化钠溶液至pH = 7,消耗氢氧化钠溶液较少的是HX
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油是工业的血液,与我们的生产、生活息息相关。
完成下列填空:
(1)可用来衡量一个国家石油化工发展水平的是__________的产量。
A.乙烷 B.乙烯 C.甲烷
(2)乙烯能使溴水褪色,说明乙烯能发生__________反应。
A.取代 B.加成 C.氧化还原
(3)甲烷和氯气在光照条件下能发生反应,反应的其中一个方程式如下:
CH4 + Cl2 → CH3Cl + HCl ,该反应属于__________反应。
A.取代 B.加成 C.氧化还原
(4)下列与异戊烷如图,互为同分异构体的是(_______)
![]()
A.  B.
B.![]() C.
C.
(5)聚乙烯安全无毒,可用于生产食品包装袋。聚乙烯的结构简式为(_______)
A.CH2=CH2 B.![]() C.
C. ![]()
(6)同系物结构相似,在分子组成上相差一个或若干个CH2原子团,请写出任意一个甲烷的同系物的结构简式。_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com