
【题目】(1)以下为中学化学中常见的几种物质:①二氧化碳②熔融KC1③NaHSO4固体④铜⑤稀硫酸⑥蔗糖⑦澄清石灰水,其中属于电解质的有_____________,属于非电解质的有__________________(填编号)。
(2)高铁酸钠(Na2FeO4)(铁为+6价)是一种新型的净水剂,可以通过下述反应制取:2Fe(OH)3+4NaOH+3NaC1O=2Na2FeO4+3NaCl+5H2O
①该反应中氧化剂是_____________(用化学式表示,后同),_____________元素被氧化,还原产物为_____________;
②当反应中有1molNaFeO4生成,转移的电子有_____________ mol;
③用单线桥法标出反应中电子转移的方向和数目。________
(3)配平该反应方程式:
______K2Cr2O7+______HCl═______KCl+______CrCl3+______Cl2↑+______H2O,
(4)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_________________。
【答案】②③ ①⑥ NaC1O Fe NaCl 3 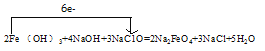 1 14 2 2 3 7 Cu+2Fe3+=Cu2++2Fe2+
1 14 2 2 3 7 Cu+2Fe3+=Cu2++2Fe2+
【解析】
(1)根据在水溶液或熔融状态下能导电的化合物为电解质,都不导电的化合物为非电解质进行分析,注意单质和混合物。
(2)根据反应中元素化合价的变化分析氧化剂和还原剂等。
(3)根据反应中的电子守恒和质量守恒分析配平反应。
(4). Cu+2Fe3+=Cu2++2Fe2+。
(1) ①二氧化碳是非电解质,②熔融KC1是电解质,③NaHSO4固体是电解质,④铜是单质,不是电解质也不是非电解质,⑤稀硫酸是溶液,属于混合物,不是电解质也不是非电解质,⑥蔗糖是非电解质,⑦澄清石灰水是溶液,是混合物,不是电解质也不是非电解质。
(2) ① 2Fe(OH)3+4NaOH+3NaC1O=2Na2FeO4+3NaCl+5H2O反应中,次氯酸钠中的氯元素化合价降低,做氧化剂,还原产物为氯化钠,氢氧化铁中的铁元素化合价升高,做还原剂,被氧化。
②该反应中转移6个电子,所以当反应中有1molNaFeO4生成,转移3mol电子。
③该反应的单线桥为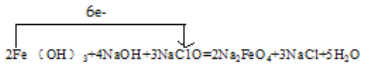
(3) ______K2Cr2O7+______HCl═______KCl+______CrCl3+______Cl2↑+______H2O,铬元素化合价从+6降低到+3,氯元素化合价从-1升高到0,根据电子守恒和质量守恒得到方程式为K2Cr2O7+14HCl═2KCl+2CrCl3+3Cl2↑+7H2O。
(4)铜和氯化铁反应生成氯化铜和氯化亚铁,离子方程式为:Cu+2Fe3+=Cu2++2Fe2+。


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案科目:高中化学 来源: 题型:
【题目】将1.12 g铁粉加入25 mL 2 mol·L-1的氯化铁溶液中,充分反应后,其结果是
A. 铁粉有剩余,溶液呈浅绿色,Cl-基本保持不变B. Fe2+和Fe3+物质的量之比为5∶1
C. 往溶液中滴入无色KSCN溶液,显红色D. 氧化产物和还原产物的物质的量之比为2∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)1mol Na2O2固体与水完全反应时转移的电子数_____________,反应的离子方程式为________________。
(2)工业上由辉铜矿生产铜的主要反应为:Cu2S+O2![]() 2Cu+SO2,该反应中被还原的元素是__________(填元素符号)。
2Cu+SO2,该反应中被还原的元素是__________(填元素符号)。
(3)反应(2)中产生的SO2尾气可用NaOH溶液吸收,若用1L 1mol/L的NaOH溶液吸收标准状况下22.4L SO2,反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐不仅是日常生活的必需品,也是重要的化工原料。工业上通过海水硒盐得到粗产品再进行精制以获得纯NaCl,精制过程如图所示:

提供的试剂:Na2CO3溶液,NaOH溶液,BaCl2溶液。
粗盐产品中含有的杂质主要有硫酸盐和MgCl2、CaCl2。
(1)欲除去溶液Ⅰ中的Ca2+、Mg2+、SO42-离子,“一系列操作”中滴加试剂的先后顺序为___、NaOH、____。(填化学式)
(2)加入碳酸钠可以除去溶液中的___(填化学式,下同)和过量的___。写出Na2CO3发生反应的两个化学方程式:___,___。
(3)加入过量盐酸的作用是___。
(4)写出盐酸参与反应的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol/L NaOH溶液分别滴定20. 00 mL 0.1000 mol/L 盐酸和20. 00 mL 0.1000 mol/L 醋酸溶液,得到2条滴定曲线,如下图所示。
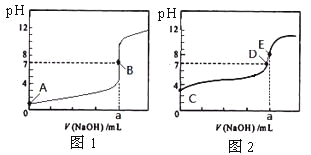
若以HA表示酸,下列说法正确的是
A. 滴定盐酸的曲线是图2
B. 达到B、D状态时,两溶液中离子浓度均为c(Na+)=C(A-)
C. 达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl)
D. 当0 mL<V(NaOH) <20. 00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A—) >c(Na+)>c(H+) >c(OH—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇分子中不同的化学键如右图,关于其在各类反应中断裂键的说明不正确的是
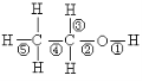
A. 和金属钠反应键①断裂
B. 和HBr在一定条件下反应时键②断裂
C. 和浓硫酸共热140℃时键①或键②断裂;170℃时键②③断裂
D. 在Ag催化下和O2反应键①③断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 使甲基橙变红色的溶液:Na+、Cu2+、ClO-、Cl-
B. 0.1 mol·L-1 Na2CO3溶液:K+、AlO![]() 、Cl-、SO42-
、Cl-、SO42-
C. 0.1 mol·L-1 (NH4)2Fe(SO4)2溶液中:H+、Al3+、Cl-、NO![]()
D. KW/c(H+)=0.1 mol·L-1的溶液中:Ca2+、NH4+、CH3COO-、HCO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是__________。

(2)在容量瓶的使用方法中,下列操作不正确的是____________
A.使用容量瓶前检验是否漏水 |
B.容量瓶用水洗净后,再用待配溶液洗涤 |
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(3)根据计算用托盘天平称取的质量为______g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度_____0.1mol/L(填“大于”“小于”或“等于”)。
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为_______mL,如果实验室有15mL、20mL、50mL量筒,应选用______mL量筒最好。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丁基甲酸是重要的有机合成中间体,以下是用烯烃A和羧酸D合成它的一种路线:

回答下列问题:
(1)A的结构简式为__________。
(2)B→C的反应类型为__________。该反应还能生成一种与C互为同分异构体的副产物,该副产物的结构简式为____________。
(3) D→E的化学方程式为_____________。
(4) M是H的同分异构体,写出同时满足下列条件的M的结构简式_____________。(不考虑立体异构)
①1molM与足量银氨溶液反应生成4molAg;②核磁共振氢谱为两组峰。
(5)根据上述合成路线中的信息,某学习小组设计以丙二酸二乙酯和1,2-二溴乙烷为原料合成二甲酸环己烷的流程图如下。则甲的结构简式为_______,乙的结构简式为_______。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com