
【题目】食盐不仅是日常生活的必需品,也是重要的化工原料。工业上通过海水硒盐得到粗产品再进行精制以获得纯NaCl,精制过程如图所示:

提供的试剂:Na2CO3溶液,NaOH溶液,BaCl2溶液。
粗盐产品中含有的杂质主要有硫酸盐和MgCl2、CaCl2。
(1)欲除去溶液Ⅰ中的Ca2+、Mg2+、SO42-离子,“一系列操作”中滴加试剂的先后顺序为___、NaOH、____。(填化学式)
(2)加入碳酸钠可以除去溶液中的___(填化学式,下同)和过量的___。写出Na2CO3发生反应的两个化学方程式:___,___。
(3)加入过量盐酸的作用是___。
(4)写出盐酸参与反应的化学方程式:___。
【答案】BaCl2溶液 Na2CO3溶液 CaCl2 BaCl2 CaCl2+Na2CO3=CaCO3↓+2NaCl BaCl2+Na2CO3=BaCO3↓+2NaCl Na2CO3和NaOH Na2CO3+2HCl=2NaCl+CO2↑+H2O、NaOH+HCl=NaCl+H2O
【解析】
(1)欲除去溶液Ⅰ中的Ca2+、Mg2+、SO42-离子,因为加入的除杂试剂都是过量的,而过量的BaCl2溶液需要使用Na2CO3溶液去除,所以Na2CO3溶液一定要放在BaCl2溶液的后面。
“一系列操作”中滴加试剂的先后顺序为BaCl2溶液。答案为:BaCl2溶液
NaOH、Na2CO3溶液。答案为:Na2CO3溶液
(2)加入碳酸钠可以除去溶液中的CaCl2。答案为:CaCl2
过量的BaCl2。答案为:BaCl2
Na2CO3发生反应的两个化学方程式:CaCl2+Na2CO3=CaCO3↓+2NaCl。
答案为:CaCl2+Na2CO3=CaCO3↓+2NaCl
BaCl2+Na2CO3=BaCO3↓+2NaCl。答案为:BaCl2+Na2CO3=BaCO3↓+2NaCl
(3)加入过量盐酸的作用是去除溶液中的Na2CO3和NaOH。
答案为:Na2CO3和NaOH
(4)盐酸参与反应的化学方程式:
Na2CO3+2HCl=2NaCl+CO2↑+H2O、NaOH+HCl=NaCl+H2O。
答案为:Na2CO3+2HCl=2NaCl+CO2↑+H2O、NaOH+HCl=NaCl+H2O


科目:高中化学 来源: 题型:
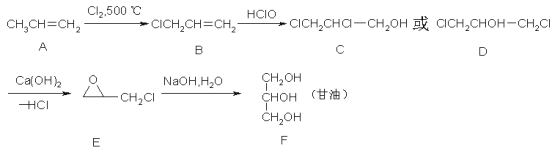
【题目】甘油(丙三醇)在纺织、医药、化妆品工业及日常生活中用途很广,可以通过以下方法合成:
完成下列填空:
(1)A中官能团的名称是____________,A→B的反应类型是__________;
(2)写出A发生加聚反应后产物的结构简式__________________;
(3)B→C的反应类型是______________,C与D互为______________;
(4)写出A→B的化学方程式:__________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25 ℃时,醋酸、次氯酸、碳酸和亚硫酸的电离平衡常数分别为醋酸K=1.75×10-5,次氯酸K=2.95×10-8,碳酸K1=4.30×10-7 K2=5.61×10-11,亚硫酸K1=1.54×10-2 K2=1.02×10-7。
(1)写出碳酸的第一级电离平衡常数表达式K1=__________。
(2)在相同条件下,等浓度的CH3COONa、NaClO、Na2CO3和Na2SO3溶液中碱性最强的是________。等浓度的Na2CO3和NaHCO3的混合溶液中各离子浓度大小顺序为______________。
(3)若保持温度不变,在醋酸溶液中通入少量HCl,下列量会变小的是________(填字母序号,下同)。
a.c(CH3COO-) b.c(H+) c.醋酸的电离平衡常数
(4)下列离子方程式中错误的是________。
a.少量CO2通入次氯酸钠溶液中:CO2+H2O+ClO-===HCO3-+HClO
b.少量SO2通入次氯酸钙溶液中:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO
c.过量CO2通入澄清石灰水中:CO2+OH-===HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镓(Ga)与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物。工业制备镓的流程如图所示:
![]()
下列判断不合理的是( )
A. Al、Ga均处于ⅢA族B. Ga2O3可与盐酸反应生成GaCl3
C. 酸性:Al(OH)3>Ga(OH)3D. Ga(OH)3可与NaOH反应生成NaGaO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。高铁酸钾为暗红色粉末状晶体,干燥的晶体80℃以下十分稳定,它极易溶于水,难溶于异丙醇。实验室模拟生产工艺流程如图:
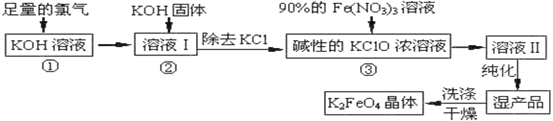
已知:①2KOH+Cl2=KCl+KClO+H2O(条件:温度较低)
②6KOH+3Cl2=5KCl+KClO3+3H2O(条件:温度较高)
③K2FeO4在水溶液中易水解:4FeO42-+10H2O![]() 4Fe(OH)3(胶体)+8OH-+3O2↑
4Fe(OH)3(胶体)+8OH-+3O2↑
回答的下列问题:
实验室可以利用如图装置完成流程①和②
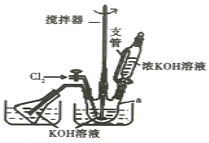
(1)恒压滴液漏斗支管的作用是_____,两水槽中的水为____(填“热水”或“冷水”)。
(2)反应一段时间后,停止通氯气,再往仪器a中加入浓KOH溶液的目的是______;判断浓KOH溶液已过量的实验依据是___。
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为____。
(4)用重结晶法提纯粗产品:将粗产品先用KOH稀溶液溶解,再加入饱和KOH溶液,冷却结晶,过滤,用少量异丙醇洗涤,最后低温真空干燥。
①粗产品用KOH溶解的目的是_____。
②如何判断K2FeO4晶体已经洗涤干净____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示。A是常见的无色液体,B是海水中最多的盐,D、F、J均为气体,C是石灰乳,L是石灰石,M具有漂白性,G、K均具有磁性,其中K为常见的金属单质。
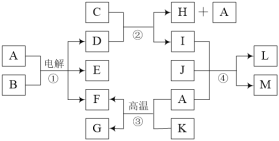
(1)E的化学式为____。
(2)A的电子式为____。
(3)写出反应③的化学方程式:____。
(4)写出反应④的离子方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)以下为中学化学中常见的几种物质:①二氧化碳②熔融KC1③NaHSO4固体④铜⑤稀硫酸⑥蔗糖⑦澄清石灰水,其中属于电解质的有_____________,属于非电解质的有__________________(填编号)。
(2)高铁酸钠(Na2FeO4)(铁为+6价)是一种新型的净水剂,可以通过下述反应制取:2Fe(OH)3+4NaOH+3NaC1O=2Na2FeO4+3NaCl+5H2O
①该反应中氧化剂是_____________(用化学式表示,后同),_____________元素被氧化,还原产物为_____________;
②当反应中有1molNaFeO4生成,转移的电子有_____________ mol;
③用单线桥法标出反应中电子转移的方向和数目。________
(3)配平该反应方程式:
______K2Cr2O7+______HCl═______KCl+______CrCl3+______Cl2↑+______H2O,
(4)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
(1)在如图所示仪器中,配制上述溶液肯定不需要的是_____(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是____。
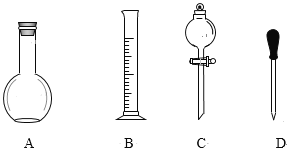
(2)在容量瓶的使用方法中,下列操作不正确的是____(多选题)。
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中。
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(3)根据计算用托盘天平称取的NaOH质量为___g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度___0.1mol/L(填“大于”“小于”或“等于”)。
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为__mL,如果实验室有10mL、20mL、50mL量筒,应选用___mL量筒最好。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个密闭容器中盛有N2和H2,它们的起始浓度分别是1.8 mol /L和5.4 mol /L,在一定的条件下它们反应生成NH3,10 min后测得N2的浓度是0.8 mol /L,则在这10 min内用NH3来表示的平均反应速率是
A.0.1 mol /(L·min)B.0.2 mol /(L·min)
C.0.3 mol /(L·min)D.0.6 mol /(L·min)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com