
����Ŀ���Ȼ���ͭ(CuCl)��һ��Ӧ�ýϹ�Ĵ������й����ʵ�ת����ϵ����ͼ��ʾ����B��E�⣬��Ϊ��Ӧ���ʵ���Һ�μӷ�Ӧ������������ͷ�Ӧ��������ȥ��������BΪ���壬��ʹƷ����Һ��ɫ��CΪ���Σ�DΪ��Ҫ�ĵ�ζ����EΪһ�ֺ�ɫ�Ľ��������M��Ħ������Ϊ34gmol-1������ˮ��Һ����ҽ������Һ��

��1��E�Ļ�ѧʽ________________________��
��2��N�ĵ���ʽΪ________________________��
��3��д����Ӧ�ٵĻ�ѧ����ʽ��_________________________________________��
��4��д����Ӧ�ڵ����ӷ���ʽ��_________________________________________��
���𰸡�Cu2O ![]() SO2+H2O2=H2SO4 2Cu2++SO32-+2Cl-+H2O
SO2+H2O2=H2SO4 2Cu2++SO32-+2Cl-+H2O![]() 2CuCl��+SO42-+2H+
2CuCl��+SO42-+2H+
��������
�������ʵ��������ʽ��������������ƶϷ�Ӧ���̣�����������ԭ��Ӧ�ĸ��������ƽ��д��ѧ�����ӷ�Ӧ����ʽ��
������ʾ��֪������BΪ���壬��ʹƷ����Һ��ɫ����B��SO2�� DΪ��Ҫ�ĵ�ζ������D��NaCl�����NaClˮ��Һ�õ�NaOH����N��NaOH��NaOH��SO2��Ӧ���ɵ�������Na2SO3����C��Na2SO3��EΪһ�ֺ�ɫ�Ľ����������E��Cu2O��M��Ħ������Ϊ34gmol-1������ˮ��Һ����ҽ������Һ����M��H2O2����Ӧ�ټ�Ϊ˫��ˮ���������Ӧ�������ᣬ����ʽΪ��SO2+H2O2=H2SO4��������Cu2O�ڼ��ȵ������·�Ӧ��������ͭ�����������ˮ����Ӧ��������ͭ���Ȼ��ơ��������Ʒ�Ӧ�����Ȼ���ͭ�����ӷ���ʽΪ��2Cu2++SO32-+2Cl-+H2O![]() 2CuCl��+SO42-+2H+��
2CuCl��+SO42-+2H+��
�ʴ�Ϊ��Cu2O��![]() ��SO2+H2O2=H2SO4��2Cu2++SO32-+2Cl-+H2O
��SO2+H2O2=H2SO4��2Cu2++SO32-+2Cl-+H2O![]() 2CuCl��+SO42-+2H+��
2CuCl��+SO42-+2H+��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵҵ�Һ�°��ڰ���Ļ����ϣ��������������Ƽ������������ͼ������������⣺

��1���ڱ���ʳ��ˮ��ͨ��X��Y����X____(����������)
��2��д��ͨ��X��Y�Ļ�ѧ��Ӧ����ʽ_____��
��3������Z____(������)��Ϊ�˵õ�����(NH4Cl)����Ҫ����ҺB��ͨ��NH3����ʳ�Σ�����ͨ��NH3������һ____�����ö�____��
��4����ҵ�����Ĵ���Ậ����NaCl���ʡ������������ⶨ�䴿�ȣ��������£��ٳ�ȡ��Ʒag����ˮ�ܽ⣻�ڼ���������BaCl2��Һ���۹��ˡ�___����ɡ���ȴ����������ɡ���ȴ��___�����յõ�����bg����Ʒ�д������������Ϊ____(�ú�a��b�Ĵ���ʽ)
��5��ij����С��Ҫ��NaOH��Һ��CO2���Ʊ�Na2CO3���壬����ֻ��δ֪Ũ�ȵ�NaOH��Һ50������������CO2�����ǵ���Ʒ����ǣ�����_____��Ȼ��_____������_____����____��������Ũ������ȴ�ᾧ�����˵ù���Na2CO3 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڵؿ�����Ҫ��NaIO3����ʽ���ڣ��ں�ˮ����Ҫ��I-����ʽ���ڣ�������֮���ת����ϵ��ͼ��ʾ����֪�����������ʵ����������˵���У�����ȷ����
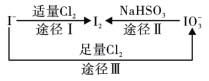
A. �����Ե�ǿ��˳��Ϊ��Cl2 >IO3- >I2
B. һ�������£� I-��IO3-��Ӧ��������I2
C. ;������������1mol I2������4mol NaHSO3
D. ��I-����Һ��ͨ��Cl2��������Һ���������Һ��һ����Ϊ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ӽ�����������ˮ��ʵ��װ����ͼ��ʾ������˵����ȷ����

A. ͨ��HR��֬����Һ�е�������Ŀ����Һ�ĵ�����������
B. HR��֬��ZOH��֬��λ�ÿɽ���
C. ͨ��HR��֬ʱ����Һ�������ӷ�ӦH����OH-�TH2O����
D. ����һ��ʱ���������֬���������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��W��X��Y��Z��ԭ��������������W��Zλ��ͬ���壬����Ԫ����ɵ�һ�ֻ�����ĽṹʽΪ ������˵������ȷ����
������˵������ȷ����
A. W������⻯����ȶ��Ա�X����
B. X��Y�γɵĻ�����ˮ��Һ�Լ���
C. W��Y�γɵĻ�������һ���������Ӽ�
D. ԭ�Ӱ뾶��Y>Z>X>W
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I���ڻ���ƽ�����װ��ǿ��ԭ���£�N2H4����ǿ��������H2O2���������ǻ��ʱ������������![]() N2��ˮ���������ų������ȣ���֪0.4molҺ̬�º�����Һ̬H2O2��Ӧ�����ɵ�����ˮ�������ų�256kJ��������
N2��ˮ���������ų������ȣ���֪0.4molҺ̬�º�����Һ̬H2O2��Ӧ�����ɵ�����ˮ�������ų�256kJ��������
��1��д���÷�Ӧ���Ȼ�ѧ����ʽ_______________________________________��
��2����֪H2O��l���TH2O��g������H=+44kJ��mol��1����16gҺ̬��ȼ�����ɵ�����Һ̬ˮʱ���ų���������________kJ��
��3������ȼ�տ���ͨ����������;����
;��I��C3H8��g��+5O2��g���T3CO2��g��+4H2O��l����H=��a kJ��mol��1
;��II��C3H8��g���TC3H6��g��+H2��g����H=+b kJ��mol��1
2C3H6��g��+9O2��g���T6CO2��g��+6H2O��l����H=��c kJ��mol��1
2H2��g��+O2 ��g���T2H2O��l����H=��d kJ��mol��1 ��abcd��Ϊ��ֵ��
��ش��������⣺
���жϵ����ı���ͨ������;���ų���������;��I�ų�������_______��������������������������С������;��II�ų���������
����C3H8��g���TC3H6��g��+H2��g�� �ķ�Ӧ�У���Ӧ����е�������________��������������������������С��������������е���������
��b ��a��c��d����ѧ��ϵʽ��_____________��
II��������ͼ��ʾװ�òⶨ�к��ȵ�ʵ�鲽�����£�

������Ͳ��ȡ50 mL 0.50 mol��L1���ᵹ��С�ձ��У���������¶ȣ�������һ��Ͳ��ȡ50 mL 0.55 mol��L1 NaOH��Һ������ͬһ�¶ȼƲ�����¶ȣ��۽�NaOH��Һ����С�ձ��У��跨ʹ֮��Ͼ��ȣ���û��Һ����¶ȡ�
�ش��������⣺
��1��Ϊʲô����NaOH��ҺҪ�Թ�����__________________________��
��2���������������������Һ���ܶȶ���1 g��cm3����֪�кͷ�Ӧ��������Һ�ı�����c��4.18 J��g1����1��Ϊ�˼����к��ȣ�ijѧ��ʵ���¼�������£�
ʵ�� ��� | ��ʼ�¶�t1/�� | ��ֹ�¶�t2/�� | |
���� | �������� | ||
1 | 20.0 | 20.0 | 23.0 |
2 | 20.1 | 20.1 | 23.2 |
3 | 20.2 | 20.2 | 23.4 |
���ݸ�ѧ����ʵ�����ݼ��㣬��ʵ���õ��к�����H��________kJ��mol1_(�������һλС��)��
��3��������Ba(OH)2��Һ�������������������Һ�����ᣬ������_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Dz��ֶ�����Ԫ�ػ��ϼ���ԭ�������Ĺ�ϵͼ������˵����ȷ���ǣ� ��

A.ԭ�Ӱ뾶��Z��Y��X
B.Y��Z��������������Ӧ��ˮ���������Ӧ
C.��̬�⻯����ȶ��ԣ�R��W
D.WX3��ˮ��Ӧ�γɵĻ����������ӻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ����ȩ��һ��ҽҩ�м��壬һ�ֺϳ�·����ͼ��

��֪����D����FeCl3��Һ������ɫ��Ӧ��E��FeCl3��Һ��������ɫ��Ӧ��
��G�ܷ���������Ӧ��
�۱����ڶ�ۼ�ȩ���Ȼ��������£�����λ���λ����ȡ����Ӧ��
�ش��������⣺
��1��A�еĹ�����������____��
��2��̼ԭ��������4����ͬ��ԭ�ӻ����ʱ����̼��Ϊ����̼����B�Ľṹ��ʽ�����Ǻţ�*�����B�е�����̼��____��
��3����Ӧ�ٵ�������_____����Ӧ��������Լ���������_____��
��4��д��D��E��Ӧ�Ļ�ѧ����ʽ��______��
��5��G�Ľṹ��ʽ��____��
��6��W��C��Ϊͬ���칹�壬W�в�����״�ṹ���ܷ���ˮ�ⷴӦ���˴Ź�������ֻ��3����ҷ����֮��Ϊ6��3��1��W�Ľṹ��ʽΪ_____��ֻдһ�֣���
��7������Ա��Ӻͣ�CH2O��nΪԭ���Ʊ� �ĺϳ�·�ߡ������Լ���ѡ��____
�ĺϳ�·�ߡ������Լ���ѡ��____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ظ����(K2Cr2O7)��һ��ǿ�������������ڼ��Ƽ��оƾ��ĺ������绯ѧ�Ʊ�K2Cr2O7��װ����ͼ��ʾ������a��b��Ϊʯī�缫������˵����ȷ����

A. X�ǵ�Դ������
B. ��������K+��b���ƶ�
C. b���Ϸ����ĵ缫��ӦΪ��2CrO42��+2H+=Cr2O72��+H2O
D. ������a��b���缫�ų�����������ʵ���֮��Ϊ2�U1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com