
【题目】爱国实业家侯德榜在氨碱法的基础上,发明了“联合制碱法”,简单流程如图。完成下列问题:

(1)在饱和食盐水中通入X和Y,则X____(填物质名称)
(2)写出通入X和Y的化学反应方程式_____。
(3)操作Z____(填名称),为了得到化肥(NH4Cl),需要在溶液B中通入NH3、加食盐,其中通入NH3的作用一____,作用二____。
(4)工业生产的纯碱常会含少量NaCl杂质。现用重量法测定其纯度,步骤如下:①称取样品ag,加水溶解;②加入足量的BaCl2溶液;③过滤、___、烘干、冷却、称量、烘干、冷却、___,最终得到固体bg。样品中纯碱的质量分数为____(用含a、b的代数式)
(5)某课外活动小组要用NaOH溶液和CO2来制备Na2CO3固体,他们只有未知浓度的NaOH溶液50毫升和足量的CO2,他们的设计方案是:首先_____,然后_____,加热_____后,再____,最后加热浓缩,冷却结晶,过滤得固体Na2CO3 。
【答案】氨气 NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl 过滤(洗涤) 将NaHCO3转化为Na2CO3 产生的NH4+有利于NH4Cl形成 洗涤 (再)称量 106b/197a 将50毫升NaOH溶液分成两等份 向其中的一份中通入过量的CO2 除去CO2 与另一份NaOH溶液混合
【解析】
(1)二氧化碳在水中的溶解度小,与水反应形成不稳定的碳酸,而把二氧化碳通入溶有氨气而呈碱性的水中,增加二氧化碳气体的吸收;
(2)碳酸氢钠的溶解度比碳酸钠小,二氧化碳通入氨化的饱和氯化钠溶液中反应生成碳酸氢钠晶体;
(3)过滤后得到的物质有杂质,需要进行洗涤;滤液(溶液B)是含有氯化铵、氯化钠和少量碳酸氢钠的溶液,通入 NH3,增大NH4+的浓度,使 NH4Cl 更多地析出,使 NaHCO3转化为溶解度更大的Na2CO3,提高析出的NH4Cl;
(4)通过称量沉淀碳酸钡的质量,根据原子守恒来计算样品中纯碱的质量分数,需洗涤沉淀,除去杂质离子,且需干燥,恒重,样品中纯碱的质量分数,根据碳守恒计算。
(5)不能直接向氢氧化钠中直接通入CO2,这样会生成碳酸氢钠溶液,但碳酸氢钠与氢氧化钠可以反应生成碳酸钠。
联合制碱法:以食盐、氨和二氧化碳为原料来制取纯碱,二氧化碳在水中的溶解度小,与水反应形成不稳定的碳酸,而把二氧化碳通入溶有氨气而呈碱性的水中,会使生成的碳酸与氨水发生反应,而增大二氧化碳气体的吸收,将氨通入饱和食盐水而成氨盐水,再通入二氧化碳生成碳酸氢钠沉淀,X为氨气,Y为二氧化碳,反应为:CO2+H2O+NaCl+NH3=NaHCO3↓+NH4Cl,经过滤(操作 z)、洗涤得NaHCO3微小晶体(晶体A),再加热制得纯碱产品,其滤液(溶液B)是含有氯化铵和氯化钠的溶液,从含有氯化铵和氯化钠的滤液中结晶沉淀出氯化铵晶体,由于氯化铵在常温下的溶解度比氯化钠要大,低温时的溶解度则比氯化钠小,在低温条件下,向滤液中加入细粉状的氯化钠,并通入氨气,可以使氯化铵单独结晶沉淀析出,经过滤、洗涤和干燥即得氯化铵产品。
(1)二氧化碳在水中的溶解度小,与水反应形成不稳定的碳酸,而把二氧化碳通入溶有氨气而呈碱性的水中,会使生成的碳酸与氨水发生反应,而增大二氧化碳气体的吸收;
(2)碳酸氢钠的溶解度比碳酸钠小,二氧化碳通入氨化的饱和氯化钠溶液中反应生成碳酸氢钠晶体;
(3)①固体、液体分离采用过滤的方法,沉淀表面有杂质,需要进行洗涤,所以操作Z可以是洗涤也可以过滤;②滤液(溶液B)是含有氯化铵、氯化钠和少量碳酸氢钠的溶液,通入 NH3,增大NH4+的浓度,使 NH4Cl 更多地析出,使 NaHCO3转化为溶解度更大的Na2CO3,提高析出的NH4Cl;
(4)加入足量的BaCl2溶液,发生反应:Na2CO3+BaCl2=BaCO3![]() +2NaCl,根据原子守恒,通过称量沉淀碳酸钡的质量,来计算样品中纯碱的质量分数,需洗涤沉淀,除去杂质离子,且将沉淀冷却到室温,恒重操作(再)称量后最终得到固体b(g)为BaCO3,根据碳守恒,纯碱的质量分数=
+2NaCl,根据原子守恒,通过称量沉淀碳酸钡的质量,来计算样品中纯碱的质量分数,需洗涤沉淀,除去杂质离子,且将沉淀冷却到室温,恒重操作(再)称量后最终得到固体b(g)为BaCO3,根据碳守恒,纯碱的质量分数=![]() 100%;
100%;
(5)不能直接向氢氧化钠中直接通入CO2,这样会生成碳酸氢钠溶液,但碳酸氢钠与氢氧化钠可以反应生成碳酸钠,所以先向溶液中通入二氧化碳气体后,在让其与氢氧化钠反应就可以得到碳酸钠溶液。


科目:高中化学 来源: 题型:
【题目】某硫酸铵样品中混有硫酸氢铵。称取不同质量的样品分别于100mL 2.300mol/L的氢氧化钠溶液充分反应,得到的实验数据入下表:
实验序号 | Ⅰ | Ⅱ |
样品质量(g) | 14.35 | 28.70 |
氨气质量(g) | 3.570 | 3.570 |
下列说法错误的是
A. 样品中硫酸铵与硫酸氢铵的物质的量之比为9:1
B. 实验Ⅰ中氢氧化钠一定过量
C. 要使实验Ⅱ的样品完全反应,需要再加入氢氧化钠0.2100mol
D. 样品中氮元素的质量分数是20.49%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含MgCl2、AlCl3均为nmol的混合溶液,向其中滴NaOH溶液至过量。加入NaOH的物质的量与生成沉淀的物质的量的关系正确的是( )
提示:离子沉淀(或沉淀溶解)pH见下表

A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行有关铜、硝酸、硫酸化学性质的实验,实验过程如图所示:

①、③均观察到实验现象:溶液呈蓝色,试管口有红棕色气体产生。下列说法正确的是
A. ①试管口有红棕色气体产生,原因是硝酸被还原为NO2
B. 由③的现象可得出结论:Cu可与稀硫酸反应
C. ③中反应的离子方程式:3Cu+2NO3-+8H+ === 3Cu2++2NO↑+4H2O
D. ③中可能产生SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是人类文明发展的重要元素之一,从传统材料到信息材料的发展过程中创造了一个又一个奇迹。
(1)工业生产粗硅的反应有:
SiO2+2C![]() Si(粗)+2CO↑
Si(粗)+2CO↑
SiO2+3C![]() SiC+2CO↑
SiC+2CO↑
两个反应的氧化剂分别为____、___。若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为___。
(2)工业上可以通过如下图所示的流程制取纯硅:
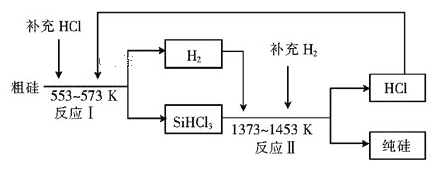
①若反应I为Si(粗)+3HCl![]() SiHCl3+H2,则反应II的化学方程式为____。
SiHCl3+H2,则反应II的化学方程式为____。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出该反应的化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要480mL 0.3 mol.·L-1 NaOH溶液和一定浓度的硫酸溶液。请回答:
(1)如图所示的仪器中,配制上述溶液一定不需要的仪器为__________(填选项字母),配制上述溶液还需用到的玻璃仪器为_________________(填仪器名称)。

(2)配制NaOH溶液。
①计算用托盘天平称取NaOH固体的质量为_____g。
②若NaOH溶液在转移至容量瓶时,洒落了少许,则所配制的溶液浓度将_______(填“偏高”、“偏低”或“无影响”)。
(3)配制硫酸溶液。
①实验室用98%(ρ=1.84g·cm3)的硫酸配制3.68mo·L-1的硫酸溶液500mL,需准确量取98%的硫酸的体积为_____mL。
②该同学实际配制硫酸溶液的浓度为3.50mol·L-1,原因可能是_________(填选项字母)。
A.用胶头滴管加水定容时俯视刻度
B.容量瓶中原来存有少量水
C.稀释硫酸的烧杯未洗涤
D.用胶头滴管加水定容时仰视刻度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: P4(g)+6Cl2(g)=4PCl3(g) △H=a kJ/mol P4(g)+10Cl2(g)=4PCl5(g) △H=b kJ/mol P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ/mol,PCl3中P-Cl键的键能为1.2c kJ/mol。 下列叙述正确的是 ( )
A. P-P键的键能大于P-Cl键的键能
B. 可求Cl2(g)+ PCl3(g)=4PCl5(s)的反应热△H
C. Cl-Cl键的键能为![]() kJ/mol
kJ/mol
D. P-P键的键能为![]() kJ/mol
kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关碳酸钠、碳酸氢钠的说法正确的是( )

A.25℃时,碳酸氢钠在水中的溶解度比碳酸钠大
B.可用澄清石灰水鉴别碳酸钠溶液和碳酸氢钠溶液
C.可用如图所示装置比较Na2CO3和 NaHCO3的热稳定性
D.常温下,浓度均为0.1mol·L-1时,碱性:NaHCO3> Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)是一种应用较广的催化剂,有关物质的转化关系如下图所示(除B、E外,均为对应物质的溶液参加反应,部分生成物和反应条件已略去)。其中B为气体,能使品红溶液褪色;C为正盐,D为重要的调味剂,E为一种红色的金属氧化物,M的摩尔质量为34gmol-1,它的水溶液常作医用消毒液。

(1)E的化学式________________________。
(2)N的电子式为________________________。
(3)写出反应①的化学方程式:_________________________________________。
(4)写出反应②的离子方程式:_________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com