
| ||
| 2s |
| 0.8mol |
| 2L |
| 1.8mol |
| 1.8mol+0.6mol+0.8mol |


 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
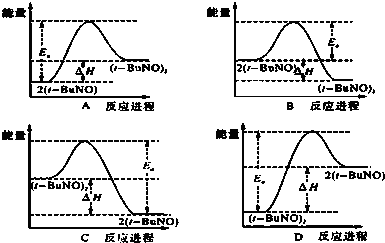

查看答案和解析>>
科目:高中化学 来源: 题型:
 )的路线如图所示:
)的路线如图所示: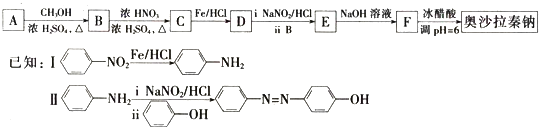
查看答案和解析>>
科目:高中化学 来源: 题型:
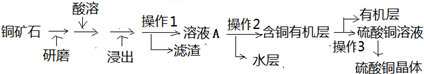
查看答案和解析>>
科目:高中化学 来源: 题型:
| 稀硫酸 |
| ① |
| 调pH约为5 |
| 适量高锰酸钾溶液② |
| 过滤 |
| Zn |
| ③ |
| 过滤 |
| Na2CO3 |
| ④ |
| 过滤 |
| 煅烧 |
| ⑤ |
| 金属离子 | Zn2+ | Fe2+ | Fe3+ | Ni2+ |
| 完全沉淀pH | 8.04 | 8.95 | 3.17 | 9.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:
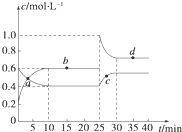 在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中发生反应:N2O4(g)??2NO2(g)△H>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示.
在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中发生反应:N2O4(g)??2NO2(g)△H>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com