

| (0.5×65%×2)2 |
| 0.5×(1-65%) |
| (2coα)2 |
| c0(1-α) |
| (2coα)2 |
| c0(1-α) |
 ,故答案为:
,故答案为: .
.


科目:高中化学 来源: 题型:
| 编号 | 金属(粉末状) | 酸的浓度 | 酸的体积 | 反应温度 |
| A | 0.1mol Mg | 6mol/L硝酸 | 10mL | 30℃ |
| B | 0.1mol Mg | 3mol/L盐酸 | 10mL | 60℃ |
| C | 0.1mol Fe | 3mol/L盐酸 | 10mL | 60℃ |
| D | 0.1mol Mg | 3mol/L盐酸 | 10mL | 30℃ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
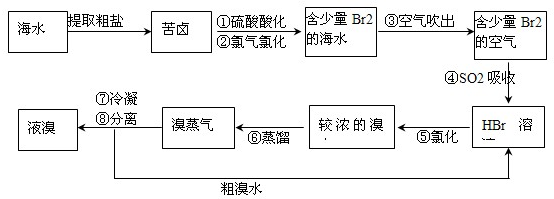
查看答案和解析>>
科目:高中化学 来源: 题型:
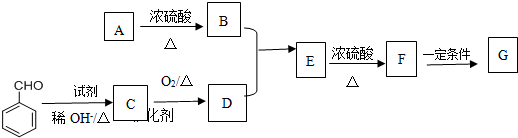
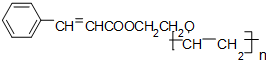
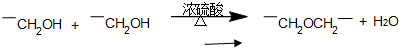
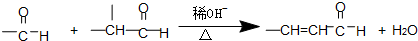
查看答案和解析>>
科目:高中化学 来源: 题型:
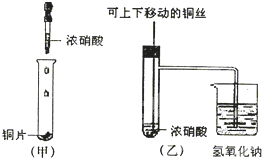 Ⅰ甲同学向品红溶液中通入一种气体后,品红褪色.乙同学设计了一个很简单的实验便知甲同学通的是Cl2还是SO2.他的实验方案是
Ⅰ甲同学向品红溶液中通入一种气体后,品红褪色.乙同学设计了一个很简单的实验便知甲同学通的是Cl2还是SO2.他的实验方案是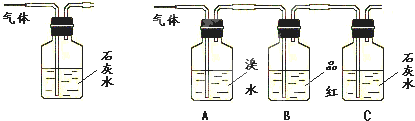
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com