
| 100 |
| 20 |
| 1.25bc |
| a |
| 5bc |
| 4a |
| 5bc |
| 4a |


科目:高中化学 来源: 题型:
| A、Al3+ Na+ NO3- Cl- |
| B、K+ Na+ Cl- NO3- |
| C、K+ Na+ Cl- HCO3- |
| D、K+ Fe2+ SO42- NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
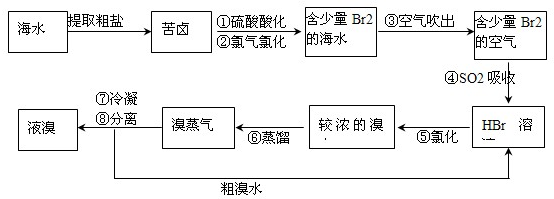
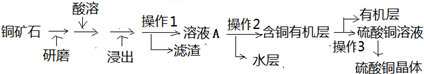
查看答案和解析>>
科目:高中化学 来源: 题型:
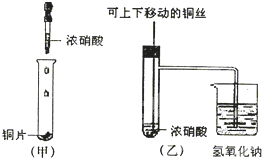 Ⅰ甲同学向品红溶液中通入一种气体后,品红褪色.乙同学设计了一个很简单的实验便知甲同学通的是Cl2还是SO2.他的实验方案是
Ⅰ甲同学向品红溶液中通入一种气体后,品红褪色.乙同学设计了一个很简单的实验便知甲同学通的是Cl2还是SO2.他的实验方案是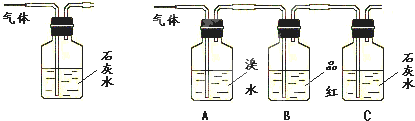
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
| ① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为棕黄色 | Fe2+具有还原性 | |
| ② | 在FeCl2溶液中加入锌片 | Zn+Fe2+→Zn2++Fe | Fe2+具有氧化性 | |
| ③ | 在FeCl3溶液中加入足量铁粉 | 溶液由棕黄色变为浅绿色 | Fe+2Fe3+→3Fe2+ | Fe3+具有氧化性 |
| ④ | 在FeCl3溶液中加入铜片 | Fe3+具有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com