
 针对如图所示乙醇分子结构,乙醇与金属钠反应时,
针对如图所示乙醇分子结构,乙醇与金属钠反应时, 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:
| A、原电池的正极和电解池的阳极所发生的反应 |
| B、原电池的正极和电解池的阴极所发生的反应 |
| C、原电池的负极和电解池的阳极所发生的反应 |
| D、原电池的负极和电解池的阴极所发生的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
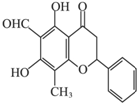 某天然有机化合物,其结构如图所示,关于该化合物的说法正确的是( )
某天然有机化合物,其结构如图所示,关于该化合物的说法正确的是( )| A、该化合物可以发生消去反应 |
| B、该化合物的分子式是C17H13O5 |
| C、一定条件下,1 mol该化合物最多可以和2molNa发生反应 |
| D、一定条件下,该化合物可以发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C1=C2 |
| B、C1>C2 |
| C、C1<C2 |
| D、C1≥C2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
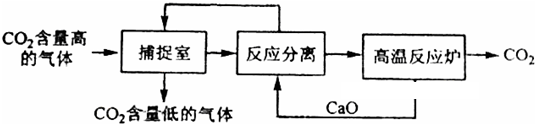
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
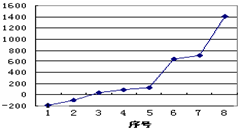 (1)第三周期8种元素按单质熔点高低的顺序
(1)第三周期8种元素按单质熔点高低的顺序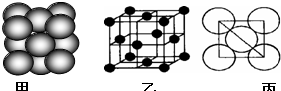
查看答案和解析>>
科目:高中化学 来源: 题型:
 下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素.
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素.| a | |||||||
| b | c | d | |||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com