
【题目】某溶液中可能含有下列7种离子中的某几种:Cl-、SO42-、HCO3-、I-、Na+、K+、Fe3+,所含离子的浓度都相等。为了确认溶液的组成,进行了如下实验:取200 mL上述溶液,加人足量Ba(OH)2溶液中,反应后将沉淀过滤、洗涤、干燥,得沉淀3.4 g。向沉淀中加入过量的盐酸,充分振荡后剩余2.33 g沉淀。下列关于该溶液的说法不正确的是
A.只存在SO42-、Cl-、Fe3+三种离子B.—定存在SO42-、Fe3+,可能存在Cl-、I-
C.c(Cl-)=0.05 mol/LD.3.4 g沉淀中含有2种成分
【答案】B
【解析】
取200mL上述溶液,加入足量Ba(OH)2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀3.4g,向沉淀中加入过量的盐酸,充分振荡后剩余2.33g沉淀,可知2.33g沉淀为硫酸钡,则含SO42-的物质的量n(SO42-)=![]() =0.01 mol,可知3.4 g沉淀为硫酸钡和其它沉淀的混合物,离子浓度均相等,沉淀若为碳酸钡,则含HCO3-,碳酸钡的质量m(BaCO3)=0.01 mol×197 g/mol=1.97g>(3.4-2.33)g=1.07 g,则不可能是碳酸钡沉淀,所以应为氢氧化铁,则含Fe3+的物质的量n(Fe3+)=
=0.01 mol,可知3.4 g沉淀为硫酸钡和其它沉淀的混合物,离子浓度均相等,沉淀若为碳酸钡,则含HCO3-,碳酸钡的质量m(BaCO3)=0.01 mol×197 g/mol=1.97g>(3.4-2.33)g=1.07 g,则不可能是碳酸钡沉淀,所以应为氢氧化铁,则含Fe3+的物质的量n(Fe3+)= ![]() =0.01 mol,由于Fe3+与HCO3-会发生盐的双水解反应,不能大量共存,与I-会发生氧化还原反应也不能大量共存,因此该溶液中不含HCO3-、I-,由电荷守恒可知,一定还含Cl-,一定不含Na+、K+,据此分析解答。
=0.01 mol,由于Fe3+与HCO3-会发生盐的双水解反应,不能大量共存,与I-会发生氧化还原反应也不能大量共存,因此该溶液中不含HCO3-、I-,由电荷守恒可知,一定还含Cl-,一定不含Na+、K+,据此分析解答。
A.由上述分析可知,一定只存在SO42-、Cl-、Fe3+三种离子,A正确;
B.由上述分析可知,一定只存在SO42-、Cl-、Fe3+三种离子,一定不含HCO3-、I-,B错误;
C.由于含有的各种离子的浓度都相等,则c(Cl-)=![]() =0.05 mol/L,C正确;
=0.05 mol/L,C正确;
D.由上述分析可知,3.4 g沉淀中含有2种成分,分别为硫酸钡、氢氧化铁,D正确;
故合理选项是B。


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】红磷(P)和白磷(P4)均为磷的同素异形体。已知:
P4(s)+5O2(g)=P4O10(s) △H=-2983.2kJ/mol
P(s)+5/4O2(g)=1/4P4O10(s) △H=-738.5kJ/mol
写出白磷转化为红磷的热化学方程式 ,由此可知,红磷比白磷 。(填“稳定”或“不稳定”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将正确答案的序号填在空白处。
(1)用经![]() 消毒的自来水配制下列溶液:①
消毒的自来水配制下列溶液:①![]() ;②
;②![]() ;③
;③![]() ;④
;④![]() ;⑤
;⑤![]() ;⑥稀盐酸,发现部分药品变质,它们是 ______ 。
;⑥稀盐酸,发现部分药品变质,它们是 ______ 。
(2)下列反应必须加入氧化剂且一步反应就能完成的是 ______ 。
①![]() ②
②![]() ③
③![]() ④
④![]() ⑤
⑤![]()
(3)在如图所示的8个装置中,属于原电池的是 ______ 。
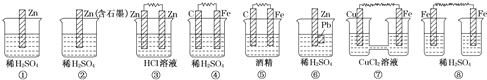
(4) ①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池。
①②相连时,外电路电流从②流向①;
②③相连时,③为正极;
②④相连时,②上有气泡逸出;
③④相连时,③的质量减少.
据此判断这四种金属活动性由大到小的顺序是 ______ 。
(5)下列物质中,不能由单质直接化合生成的是 ______ 。
①![]() ②
②![]() ③
③![]() ④
④![]() ⑤
⑤![]()
(6)下列物质中,属于强电解质的是 ______ ;属于非电解质的是 ______ 。
①氨气②氨水③盐酸④醋酸⑤硫酸钡⑥氯化银 ⑦氯化钠⑧二氧化碳⑨醋酸铵⑩氢气![]() 水
水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,二氯化二硫(S2Cl2)为橙黄色液体,遇水易水解,工业上用于橡胶的硫化。某学习小组用氯气和硫单质合成S2Cl2的实验装置如图所示.下列说法正确的是
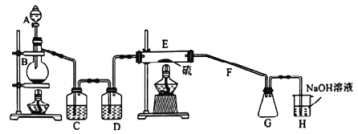
A. 实验时需先点燃E处的酒精灯
B. C、D中所盛试剂为饱和氯化钠溶液、浓硫酸
C. 二氯化二硫(S2Cl2)水解反应产物为:S、H2S、HCl
D. G中可收集到纯净的产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:

A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可逆反应2NO2(g)![]() 2NO(g)+O2(g),在恒压密闭容器中充入NO2,该反应达到化学平衡状态的标志是( )
2NO(g)+O2(g),在恒压密闭容器中充入NO2,该反应达到化学平衡状态的标志是( )
A.反应停止了
B.NO的正反应速率与O2的逆反应速率相等
C.c(NO):c(O2)=2:1
D.混合气体的颜色不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下发生反应:3A(g)+2B(g) ![]() xC(g)+2D(g),在2 L密闭容器中,把4 mol A和2 mol B混合,2 min后达到平衡时生成1.6 mol C,又测得反应速率vB=0.2 mol·L-1·min-1,则下列说法中正确的是( )
xC(g)+2D(g),在2 L密闭容器中,把4 mol A和2 mol B混合,2 min后达到平衡时生成1.6 mol C,又测得反应速率vB=0.2 mol·L-1·min-1,则下列说法中正确的是( )
A. x=3B. B的转化率为20%
C. 平衡时气体压强是原来的0.94倍D. 达到平衡时A的浓度为1.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水![]() 广泛用作有机反应催化剂。实验室采用镁屑与液溴为原料制备无水
广泛用作有机反应催化剂。实验室采用镁屑与液溴为原料制备无水![]() ,装置如图1,主要步骤如下:
,装置如图1,主要步骤如下:
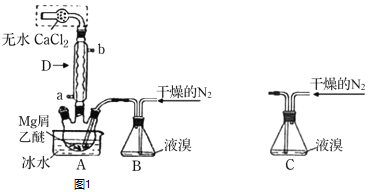
步骤1三颈瓶中装入10g镁屑和150mL无水乙醚;装置B中加入15mL液溴。
步骤2缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至![]() ,析出晶体,再过滤得三乙醚合溴化镁粗品。
,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4常温下用苯溶解粗品,冷却至![]() ,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至
,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至![]() 分解得无水
分解得无水![]() 产品。
产品。
已知:![]() 和
和![]() 反应剧烈放热;乙醚
反应剧烈放热;乙醚![]() 极易挥发;
极易挥发;
![]() 具有强吸水性。
具有强吸水性。
![]()
![]()
![]()
请回答下列问题:
![]() 仪器D的名称是___________________。冷凝水应该从________
仪器D的名称是___________________。冷凝水应该从________![]() 填a或
填a或![]() 口通入;
口通入;
![]() 干燥的
干燥的![]() 可将液溴吹出,是因为液溴具有___________的性质;实验中不能用干燥空气代替干燥
可将液溴吹出,是因为液溴具有___________的性质;实验中不能用干燥空气代替干燥![]() ,原因是___________;
,原因是___________;
![]() 将装置B改为装置C,可能会导致的后果是_____________________________;
将装置B改为装置C,可能会导致的后果是_____________________________;
![]() 步骤3中,第一次过滤除去的物质是___________________________________;
步骤3中,第一次过滤除去的物质是___________________________________;
![]() 试用平衡移动的原理说明得到三乙醚合溴化镁后,加热有利于其分解,得无水
试用平衡移动的原理说明得到三乙醚合溴化镁后,加热有利于其分解,得无水![]() 产品的原因:__________________________;
产品的原因:__________________________;
![]() 为测定产品的纯度,可用EDTA标准溶液滴定,反应的离子方程式:
为测定产品的纯度,可用EDTA标准溶液滴定,反应的离子方程式:![]() ;测定前,先称取
;测定前,先称取![]() 无水
无水![]() 产品,溶解后,用0.0500mol/L的EDTA标准溶液滴定至终点,消耗EDTA标准溶液20.00mL,则测得无水
产品,溶解后,用0.0500mol/L的EDTA标准溶液滴定至终点,消耗EDTA标准溶液20.00mL,则测得无水![]() 产品的纯度是_________________
产品的纯度是_________________![]() 以质量分数表示
以质量分数表示![]() 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com