
【题目】下列反应的离子方程式正确的是![]()
A.向![]() 溶液中加入过量氨水:
溶液中加入过量氨水:![]()
B.![]() 溶液与过量NaOH溶液反应制
溶液与过量NaOH溶液反应制![]() :
:![]()
C.向![]() 溶液中通入过量的
溶液中通入过量的![]() :
:![]()
D.![]() 溶于稀
溶于稀![]() :
:![]()
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器中,800℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)已知:K(300℃)>K(350℃),该反应是____热反应。
(2)如图中表示NO2浓度变化曲线的是__(填序号),用O2表示从0~2 s内该反应的平均速率v=___。
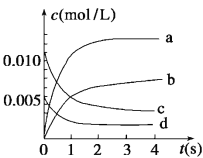
(3)能说明该反应已经达到平衡状态的是__(填字母序号)。
a.c(NO2)=2c(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内的密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是___(填字母序号)。
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列现象或事实可用同一原理解释的是
A.浓硫酸和浓盐酸长期暴露在空气中浓度降低
B.亚硫酸钠溶液和氯化铝溶液在空气中蒸干不能得到对应的溶质
C.漂白粉、活性炭、![]() 都能使红墨水褪色
都能使红墨水褪色
D.![]() 和
和![]() 溶液使酸性高锰酸钾的紫色褪去
溶液使酸性高锰酸钾的紫色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同族,它们原子的最外层电子排布式为ns1。B和D也属同族,它们原子最外层的p能级电子数是s能级电子数的两倍。C原子的最外层电子数等于D原子的最外层电子数的一半。请回答下列问题:
(1)写出C元素基态原子的电子排布式: ________________ 。
(2)用电子排布图表示D元素原子的价电子:__________。
(3)元素B与D的电负性的大小关系是B___ D (填“>”“<”或“=”,下同), E与C的第一电离能大小关系是E____C。
(4)写出元素E和C的最高价氧化物对应的水化物之间反应的离子方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是![]()
![]()
A.将铁放入氯化铁溶液中:![]()
B.向新制的氢氧化亚铁中加入足量的稀硝酸:![]()
C.将少量的二氧化硫通入氢氧化钠溶液中:![]()
D.向氯化铝溶液中加入过量的氢氧化钠溶液:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有下列7种离子中的某几种:Cl-、SO42-、HCO3-、I-、Na+、K+、Fe3+,所含离子的浓度都相等。为了确认溶液的组成,进行了如下实验:取200 mL上述溶液,加人足量Ba(OH)2溶液中,反应后将沉淀过滤、洗涤、干燥,得沉淀3.4 g。向沉淀中加入过量的盐酸,充分振荡后剩余2.33 g沉淀。下列关于该溶液的说法不正确的是
A.只存在SO42-、Cl-、Fe3+三种离子B.—定存在SO42-、Fe3+,可能存在Cl-、I-
C.c(Cl-)=0.05 mol/LD.3.4 g沉淀中含有2种成分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合氯化铝晶体是介于AlCl3和A1(OH)3之间的一种水溶性无机高分子聚合物,其制备原料主要是铝加工行业的废渣——铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产工艺流程如图:
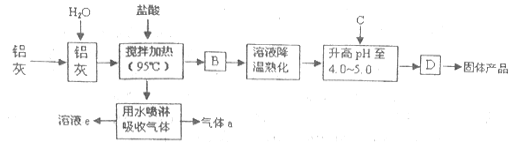
(1)反应中副产品a是___(用化学式表示);
(2)升高pH至4.0~4.5的目的是__;
(3)生产过程中可循环使用的物质是__(用化学式表示);
(4)为使得到的晶体较纯净,生产过程中使pH升高的C物质可选用___(填编号);
a.NaOH b.Al c.氨水 d.A12O3 e.NaAlO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液氨与水性质相似,也存在微弱的电离:2NH3![]() NH4++NH2—,其离子积常数K=c(NH4+)·c(NH2—)=2×l0-30,维持温度不变,向液氨中加入少量NH4Cl固体或NaNH2固体,不发生改变的是
NH4++NH2—,其离子积常数K=c(NH4+)·c(NH2—)=2×l0-30,维持温度不变,向液氨中加入少量NH4Cl固体或NaNH2固体,不发生改变的是
A. 液氨的电离平衡 B. 液氨的离子积常数
C. c(NH4+) D. c(NH2—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化阿托醛![]() 是一种重要的化工原料,其合成路线如下:
是一种重要的化工原料,其合成路线如下:
(1)氢化阿托醛被催化氧化后的含氧官能团的名称是____________.
(2)在合成路线上②③的反应类型分别为②_____________③________________.
(3)反应④发生的条件是_____________________.
(4)由![]() 反应的化学方程式为_______________________________
反应的化学方程式为_______________________________
(5)1mol氢化阿托醛最多可和____mol氢气加成,1mol氢化阿托醛发生银镜反应可生成________molAg.
(6)D与有机物X在一定条件下可生成一种相对分子质量为178的酯类物质,则X的结构简式为________.D有多种同分异构体,能满足苯环上有两个取代基,且能使FeCl3溶液显紫色的同分异构体有______种.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com