
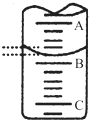
 某研究性小组用0.20mol/L NaOH溶液滴定未知浓度的白醋(指示剂为酚酞).
某研究性小组用0.20mol/L NaOH溶液滴定未知浓度的白醋(指示剂为酚酞).| 滴定 次数 | 标准NaOH溶液体积/mL | |
| 滴定前度数/mL | 滴定后读数/mL | |
| 第一次 | 0.02 | 25.00 |
| 第二次 | 0.01 | 25.03 |
| 第三次 | 0.03 | 26.35 |
| V(标准)×c(标准) |
| V(待测) |
| V(标准)×c(标准) |
| V(待测) |
| V(标准)×c(标准) |
| V(待测) |
| 0.20mol/L×25.00mL |
| 20.00ml |
| V(标准)×c(标准) |
| V(待测) |
| V(标准)×c(标准) |
| V(待测) |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
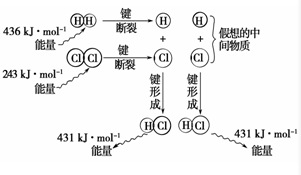 实验测得1mol H2与1mol Cl2反应生成2mol HCl时,放出184.6kJ的热量,其理论分析数据与实验数据略有差异,如图表示上述反应能量变化的理论分析示意图:
实验测得1mol H2与1mol Cl2反应生成2mol HCl时,放出184.6kJ的热量,其理论分析数据与实验数据略有差异,如图表示上述反应能量变化的理论分析示意图:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、节日期间,在人群密集处燃放烟花爆竹 |
| B、寻找一种高效催化剂将水直接变成汽油 |
| C、炒菜时油锅中的油不慎着火,迅速盖上锅盖 |
| D、用点燃的火柴在液化气钢瓶口检验是否漏气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
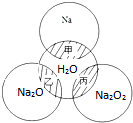 如图所示,两圆圈相交的阴影部分甲、乙、丙表示圆圈内物质相互发生的反应,钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )
如图所示,两圆圈相交的阴影部分甲、乙、丙表示圆圈内物质相互发生的反应,钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )| A、甲、乙、丙都属于氧化还原反应 |
| B、丙反应中的氧化剂是Na2O2,还原剂时H2O |
| C、丙反应中消耗1molNa2O2,则转移1mol电子 |
| D、若甲、乙、丙反应后所得溶液的质量分数分别为w1、w2、w3,则:2w1=w2=w3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 测定序号 | 待测溶液的体积(mL) | 所耗盐酸标准液的体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.20 | 21.32 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、从平衡混合气体中分离出CO2可增大平衡常数K |
| B、平衡后,其他条件不变,加入硫,逆反应速率加快 |
| C、平衡后,若升高温度,CO体积分数增大,则正反应的△H<0 |
| D、平衡后,其他条件不变,通入CO2,该反应的△H减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com