
【题目】已知:pOH=-lgc(OH-)。常温下,某弱酸的钠盐(Na2XO3)溶液中微粒浓度的变化关系如下图所示。下列说法正确的是

A. 实线M表示pOH与lg 的变化关系
的变化关系
B. 在NaHXO3溶液中:![]() >1
>1
C. 向Na2XO3溶液中滴加稀盐酸至溶液显中性时:c(Na+)+2c(H+)=c(HXO3-)+2c(XO32-)+2c(OH-)
D. Na2XO3溶液加水稀释,![]() 先增大后不变
先增大后不变
【答案】B
【解析】Na2XO3为强碱弱酸盐,水解显碱性,分2步水解:XO32-+H2O== HXO3-+ OH- HXO3-+ H2O==H2XO3+OH-;水解的第一步程度较大,因此c(HXO3-) /c(XO32-)比值较大,当c(HXO3-) /c(XO32-)=10-4时,溶液的碱性最强,pOH=0;第二步水解受到第一步抑制,水解程度较小,c(H2XO3)/c(HXO3-)比值较小,当c(H2XO3)/ c(HXO3-)=10—9时,溶液的碱性最强,溶液 pOH=0;所以实线M表示pOH与![]() 的变化关系,A错误;
的变化关系,A错误;![]() =c(OH-)×c(HXO3-)×c(H2XO3)/ c(H+)×c(XO32-)×c(HXO3-)=Kh/Ka1,根据图像当
=c(OH-)×c(HXO3-)×c(H2XO3)/ c(H+)×c(XO32-)×c(HXO3-)=Kh/Ka1,根据图像当![]() =0时,溶液的pOH=4;水解大于电离过程,溶液显碱性,所以Kh/Ka1>1,即:
=0时,溶液的pOH=4;水解大于电离过程,溶液显碱性,所以Kh/Ka1>1,即:![]() >1,B正确;向Na2XO3溶液中滴加稀盐酸至溶液显中性时,溶液中存在电荷守恒:c(Na+)+c(H+)=c(HXO3-)+2c(XO32-)+c(OH-),C错误;Na2XO3溶液加水稀释,水解程度增大,但是溶液中c(HXO3-)、c(OH-)均减小,温度不变,KW不变,因此c(H+)增大;Na2XO3溶液加水稀释,
>1,B正确;向Na2XO3溶液中滴加稀盐酸至溶液显中性时,溶液中存在电荷守恒:c(Na+)+c(H+)=c(HXO3-)+2c(XO32-)+c(OH-),C错误;Na2XO3溶液加水稀释,水解程度增大,但是溶液中c(HXO3-)、c(OH-)均减小,温度不变,KW不变,因此c(H+)增大;Na2XO3溶液加水稀释,![]() 一直增大;D错误;正确选项B。
一直增大;D错误;正确选项B。


科目:高中化学 来源: 题型:
【题目】下列实验现象预测正确的是( )
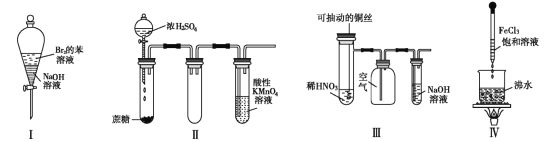
A. 实验Ⅰ:振荡后静置,上层溶液颜色保持不变
B. 实验Ⅱ :酸性 KMnO4 溶液中出现气泡,且颜色逐渐褪去
C. 实验Ⅲ:微热稀 HNO3 片刻,溶液中有气泡产生,广口瓶内始终保持无色
D. 实验Ⅳ:滴入 FeCl3 后,可形成带电的胶体,该分散系导电能力增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在C2H2、C6H6、C2H4O组成的混合物中,已知碳元素的质量分数为84%,则混合物中氧元素的质量分数是( )
A. 9% B. 8% C. 7% D. 12%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气在生产生活中有广泛的用途,制取氯气的途径有多种。完成下列填空:
(1)工业上用电解饱和食盐水制取氯气,氯气在电解池的______极产生;氯气与氢氧化钠反应得到消毒剂次氯酸钠,发生反应的化学方程式为________;向次氯酸钠溶液中加入少量稀盐酸,可以增强消毒效果,这是因为生成了_____(填物质名称)。
(2)实验室制取氯气的化学方程式为MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,该反应中,氯气是______(填“氧化”或“还原”)产物;若反应过程中转移了2 mol电子,则在标准状况下可以得到_______L氯气。
MnCl2+Cl2↑+2H2O,该反应中,氯气是______(填“氧化”或“还原”)产物;若反应过程中转移了2 mol电子,则在标准状况下可以得到_______L氯气。
(3)实验室常用排饱和食盐水的方法收集氯气,请用平衡移动原理解释用饱和食盐水而不用水的原因。___________
(4)有机化工中会利用反应4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)+Q(Q>0)来产生氯气。向5 L的密闭容器中加入0.5 mol HCl与0.2 mol O2,在一定条件下发生反应,Cl2的物质的量与时间t的关系如图中OA段所示。0~8 min时Cl2的平均反应速率为_________________。t0时刻改变某一条件,Cl2的物质的量变化曲线如图中AB段所示,则t0时改变的条件一定是__________。
2Cl2(g)+2H2O(g)+Q(Q>0)来产生氯气。向5 L的密闭容器中加入0.5 mol HCl与0.2 mol O2,在一定条件下发生反应,Cl2的物质的量与时间t的关系如图中OA段所示。0~8 min时Cl2的平均反应速率为_________________。t0时刻改变某一条件,Cl2的物质的量变化曲线如图中AB段所示,则t0时改变的条件一定是__________。
a.降低温度 b.增大压强 c.加入HCl

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是
A. PM2.5和PM10都是空气质量指数(AQI)的重要指标
B. 汽车尾气中的NO2和CO2都是大气污染
C. 聚乙烯和聚氯乙烯随意乱扔都能产生白色污染
D. 含N和P的大量污水任意排放都能导致水体富营养化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有饱和溶液.下列说法正确的是( ) 
A.a电极上发生的反应为:MnO4﹣+8H++5e﹣═Mn2++4H2O
B.外电路电子的流向是从a到b
C.电池工作时,盐桥中的SO42﹣移向甲烧杯
D.b电极上发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“钢是虎,钒是翼,钢含钒犹如虎添翼”,金属钒被誉为“合金的维生素”。从废钒(主要成分为V2O5、Fe2O3、SiO2等)中回收V2O5的一种工艺流程如下图所示: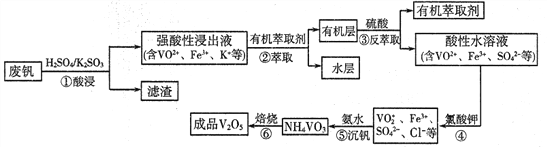
已知:步骤②、③中的变化过程可简化为:Rn+(水层)+nHA(有机层)![]() RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)。
RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)。
回答下列问题:
(1)步骤①酸浸过程中发生氧化还原反应的化学方程式为______________。
(2)萃取时应加入适量碱的作用是___________________。
(3)步骤④中反应的离子方程式为___________________。
(4)步骤⑤25°C时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
通过表中数据分析,在实际生产中,⑤中加入氨水,调节溶液的最佳pH范围为______;
若加入氨水调节溶液pH=2,钒沉淀率达到93%且不产生Fe(OH)3沉淀,则此时溶液中c(Fe3+)<_____mol/L(按25℃计算,25℃时Ksp[Fe(OH)3]=2.6×10-39)。
(5)V2O5是两性氧化物,在强酸性溶液中以VO2+形式存在,VO2+具有强氧化性,能将I-氧化为I2,本身被还原为VO+,则V2O5与氢碘酸反应的离子方程式为_________________。
(6)为提高钒的回收率,步骤②和③需多次进行,假设酸浸所得“强酸性浸出液”中c(VO2+)=amol/L,步骤②和③每进行一次,VO2+萃取率为80%,4次操作后,“强酸性浸出液中”c(VO2+)=_______mol/L(萃取率=![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com