
【题目】G是药物合成的中间体,其部分合成路线如下:
已知:RCHO + CH3COR1 ![]() RCH=CHCOR1 + H2O
RCH=CHCOR1 + H2O
请回答下列问题:
(1)C→D的反应类型为_______________。
(2)试剂E的名称为_____________,G的分子式为_______________。
(3)写出A→B的化学方程式__________________________________。
(4)设计A→B步骤的目的是__________________ 。
(5)芳香族化合物T是D的同分异构体,满足下列条件的结构一共有___ 种。
①能发生银镜反应;
②遇FeCl3溶液不发生显色反应,其在稀硫酸中的水解产物之一遇FeCl3溶液能发生显色反应;
③在核磁共振氢谱上有七组峰;
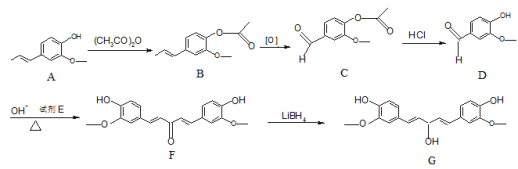
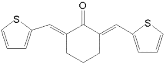
(6)以环己醇和![]() 为原料,合成
为原料,合成 的路线为__________________________。
的路线为__________________________。
【答案】取代反应 丙酮 C19H20O5  +(CH3CO)2O→
+(CH3CO)2O→ +CH3COOH 保护酚羟基 2
+CH3COOH 保护酚羟基 2 ![]()
![]()
![]()
![]()
![]()

【解析】
结合A、B结构简式可知A→B的反应时乙酸酐与酚羟基发生取代反应,B被氧化为C,C含有酯基,在酸性条件下发生水解反应生成D;根据信息中羟醛缩合的反应特征,结合D、F的结构简式对比可知,E为丙酮CH3COCH3,F在LiBH4作用下发生还原反应生成G;
(6)分析目标产物和原料,结合已知信息羟醛缩合可知,将环己醇氧化为环己酮,再发生羟醛缩合反应,最后将酮重新还原为醇即可。
(1)根据分析C含有酯基,在酸性条件下发生水解反应生成D,水解反应属于取代反应;
(2)结合分析,根据信息中羟醛缩合的反应特征,结合D、F的结构简式对比可知,E为丙酮CH3COCH3;由G的结构简式,每个节点为碳原子,每个碳原子形成4个共价键,不足键用氢原子补齐,可知G的分子式为:C19H20O5;
(3)结合A、B结构简式可知A→B的反应时乙酸酐与酚羟基发生取代反应,反应的副产物是CH3COOH,则反应方程式为: +(CH3CO)2O→
+(CH3CO)2O→ +CH3COOH;
+CH3COOH;
(4)A→B将羟基变成酯基,C→D将酯基变成羟基,结合B→C是氧化反应,则设计A→B步骤的目的是避免酚羟基被氧化,其目的是保护羟基;
(5)依题意,T能发生银镜反应,遇FeCl3溶液不发生显色反应,但其在稀硫酸中水解的产物之一遇FeCl3溶液能发生显色反应,说明含有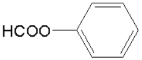 结构且不含酚羟基,结合D的分子式为C8H8O3,所以T含两个取代基:第一组是HCOO-、-CH2OH;第二组是HCOO-、-OCH3,在核磁共振氢谱上有七组峰,所以T的结构只能是第一组,并且两个官能团不在对位,只能在邻位和间位,符合条件的同分异构体有2种;
结构且不含酚羟基,结合D的分子式为C8H8O3,所以T含两个取代基:第一组是HCOO-、-CH2OH;第二组是HCOO-、-OCH3,在核磁共振氢谱上有七组峰,所以T的结构只能是第一组,并且两个官能团不在对位,只能在邻位和间位,符合条件的同分异构体有2种;
(6)分析目标产物和原料,结合已知信息羟醛缩合可知,将环己醇氧化为环己酮,再发生羟醛缩合反应,最后将酮重新还原为醇即可,则合成路线为:![]()
![]()
![]()
![]()

![]()
 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】一种用软锰矿(主要成分MnO2)和黄铁矿(主要成分FeS2)制取MnSO4·H2O并回收单质硫的工艺流程如下:
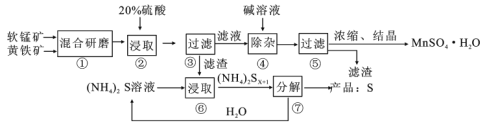
(1)步骤①混合研磨成细粉的主要目的是__________;步骤②浸取时若生成S、MnSO4及Fe2(SO4)3,则反应的离子方程式为___________。
(2)步骤③所得酸性滤液可能含有Fe2+,检验Fe2+的方法是________;除去Fe2+的方法是__________。步骤④是破坏Fe(OH)3胶体并使沉淀颗粒长大,便于过滤分离。步骤⑤所得滤渣为___________(填化学式)。
(3)步骤⑦需在90~100℃下进行,该反应的化学方程式为___________。
(4)硫化铵水解的离子方程式为:S2-+![]() +H2O
+H2O![]() HS-+NH3·H2O,如何判断溶液的酸碱性______。
HS-+NH3·H2O,如何判断溶液的酸碱性______。
(5)测定产品MnSO4·H2O的方法之一是:准确称取a g产品于锥形瓶中,加入适量ZnO及H2O煮沸,然后用c mol·L-1 KMnO4标准溶液滴定至浅红色且半分钟不褪,消耗标准溶液V mL,滴定反应的离子方程式为2![]() +3Mn2++2H2O=5MnO2↓+4H+,产品中Mn2+的质量分数为ω(Mn2+)=___________。
+3Mn2++2H2O=5MnO2↓+4H+,产品中Mn2+的质量分数为ω(Mn2+)=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
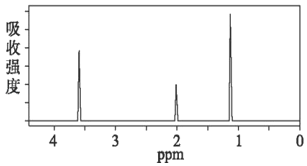
【题目】取0.92 g由C、H、O三种元素组成的有机物A,在足量氧气中完全燃烧,若将燃烧产物通过碱石灰,碱石灰质量增加2.84 g;若将燃烧产物通过浓硫酸,浓硫酸质量增加1.08 g;已知:A的蒸气对氢气的相对密度为23。
(1)A的分子式是_____;
(2)A的1H核磁共振谱图如图所示,写出其结构简式:_____;它的一种同分异构体的结构简式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是
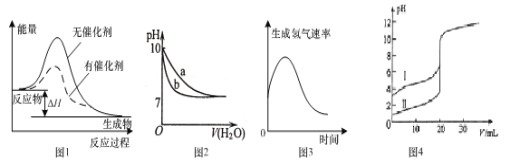
A.图1表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图2表示相同温度下,向pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH变化曲线,其中b表示氨水稀释时pH的变化曲线
C.图3表示镁条放入盐酸中生成氢气速率随时间的变化,起初反应速率加快的原因能是该反应为放热反应
D.图4表示室温下,用0.l00mol ·L-1NaOH溶液分别滴定20.00 mL 0.100 mol ·L-1的盐酸和醋酸,其中I表示的是滴定盐酸的曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知合成氨反应N2(g)+ 3H2(g) ![]() 2NH3(g) △H<0,当反应器中按n(N2): n(H2)=1:3投料后,在不同温度下,反应达到平衡时,得到混合物中NH3的物质的量分数随压强的变化曲线a,b,c如下图所示。下列说法正确的是( )
2NH3(g) △H<0,当反应器中按n(N2): n(H2)=1:3投料后,在不同温度下,反应达到平衡时,得到混合物中NH3的物质的量分数随压强的变化曲线a,b,c如下图所示。下列说法正确的是( )

A. 曲线a对应的反应温度最高
B. 上图中M、N、Q点平衡常数K的大小关系为K(M)=K(Q)<K(N)
C. 相同压强下,投料相同,达到平衡所需时间关系为c>b>a
D. N点时 c(NN3)=0.2 mol/L,则 N点的c(N2): c(NH3)=1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是( )
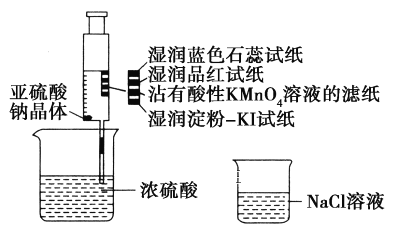
A. 蓝色石蕊试纸先变红后褪色
B. 品红试纸、沾有酸性KMnO4溶液的滤纸均褪色,证明SO2具有漂白性
C. 湿润淀粉-KI试纸未变蓝说明SO2的氧化性弱于I2
D. NaCl溶液可用于除去实验中多余的SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组查阅资料得知,漂白粉与硫酸溶液加热反应可制取氯气,他们设计如下实验用于制取氯气并验证其性质。
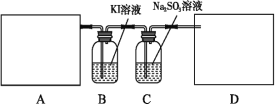
试回答:
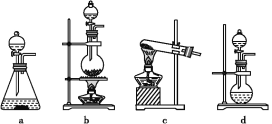
(1)该实验中A部分的装置是___________ (填写字母)。A部分的装置中发生反应的化学方程式为:___________。
(2)B中的发生反应的离子方程式为____________。
(3)用离子方程式表示C中亚硫酸钠被氧化的主要原因:___________。请你帮助他们设计一个实验,证明洗气瓶C中的亚硫酸钠已被氧化(简述实验步骤)__________。
(4)请根据题意画出D处的实验装置图,并注明盛放的物质___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自门捷列夫绘制第一张元素周期来以来,经过多次的演变,出现了多种形式的元素周期表,其揭示的规律在多领城发挥了重要作用。下表是元素周期表中部分短周期主族元素的有关信息:
元素编号 | 元素性质或原子结构 |
T | 核外有 5 种不同能量的电子,且最外层有 2 对成对电子 |
X | 最高化合价为+7 价 |
Y | 短周期主族元素原子中半径最大 |
Z | 最高价氧化物对应水化物具有两性 |
(1)上述四种元素中,其简单离子的半径最小的是________(填离子符号)。
(2)T 和 X 对应的元素,其气态氢化物稳定性较强的是_______(填化学式)。
(3)用原子结构的知识,说明 T 和 X 对应元素的非金属性的相对强弱。在 T 对应元素的气态氢化物,其水溶液中滴加 X 单质的水溶液,现象是_______,写出反应的离子方程式 _______。
(4)Y 和 Z 对应元素,其最高价氧化物对应水化物可发生反应。写出该反应的离子方程式________。
(5)可用 Z 对应元素的单质,与氧化铁反应来冶炼铁。若反应中生成了11.2g单质,则转移电子的数目为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯元素是中学化学中常见的重要非金属元素之一,氯元素的单质及其化合物在生产与生活中有着重要的用途,依据所学知识完成下列问题:
Ⅰ.实验室制备氯气的化学方程式是_____________________;多余的氯气用氢氧化钠溶液吸收,其离子方程式为_________________
Ⅱ.常温下,二氧化氯(ClO2)是一种黄绿色气体,具有强氧化性,已被联合国世界卫生组织(WHO)列为高效安全消毒剂。常温下,它可用氯酸钠固体与浓盐酸反应制备得到,还有 NaCl与C12生成。
(1)写出并配平该反应的化学方程式____________________。
(2)如果反应中生成标准状况下11.2L 氯气,则被氧化的 HCl的物质的量为_______,转移电子数为_________。
(3)二氧化氯可迅速氧化硫化物(其中还原产物中氯元素为负一价),以除去水中硫化物产生的臭味。取适量ClO2,通入到含有H2S(二元弱酸)的水中,再向共中加入少量氯化钡溶液,发现有白色沉淀生成。写出ClO2与H2S水溶液反应的离子方程式____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com