
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 饱和碳酸钠溶液中析出1.06g晶体,该晶体中含有2 NA个Na+
B. 1mol乙酸与足量的乙醇发生酯化反应,生成乙酸乙酯分子数为NA个
C. 某温度下,1L pH=2的H2SO4溶液中,硫酸和水电离的H+总数为0.01NA
D. 常温常压下,NO2与N2O4的混合气体46g,分子总数为NA
【答案】C
【解析】
A、饱和碳酸钠溶液中析出1.06g晶体,即![]() 碳酸钠,其中含有0.02 NA个Na+,故A错误;B、酯化反应为可逆反应,不能进行彻底,所以1mol乙酸与足量的乙醇发生酯化反应,生成乙酸乙酯分子数小于NA个,故B错误;C、某温度下,1L pH=2的H2SO4溶液中H+总数为0.01NA,是由硫酸和水电离的,故C正确;D、NO2与N2O4的混合气体46g,假设全部是NO2,所含分子物质的量为
碳酸钠,其中含有0.02 NA个Na+,故A错误;B、酯化反应为可逆反应,不能进行彻底,所以1mol乙酸与足量的乙醇发生酯化反应,生成乙酸乙酯分子数小于NA个,故B错误;C、某温度下,1L pH=2的H2SO4溶液中H+总数为0.01NA,是由硫酸和水电离的,故C正确;D、NO2与N2O4的混合气体46g,假设全部是NO2,所含分子物质的量为![]() ,即分子总数为NA,假设全部为N2O4所含分子物质的量为
,即分子总数为NA,假设全部为N2O4所含分子物质的量为![]() ,即分子总数为0.5 NA,所以NO2与N2O4的混合气体46g,分子总数为N得取值范围是0.5NA <N< NA,故D错误;故选C。
,即分子总数为0.5 NA,所以NO2与N2O4的混合气体46g,分子总数为N得取值范围是0.5NA <N< NA,故D错误;故选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列关于胶体的叙述中不正确的是
A. 丁达尔现象可用来区别胶体与溶液
B. 溶液、胶体、浊液的根本区别是分散质粒子直径的大小
C. 胶体在一定条件下会发生聚沉
D. 胶体粒子能通过半透膜,不能通过滤纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知100℃时,水的离子积常数Kw=1×10-12,对于该温度下pH=l1的氨水,下列叙述正确的是
A. 向该溶液中加入同温同体积pH=1的盐酸,反应后溶液呈中性
B. 温度降低至25℃,该氨水溶液中H2O电离出的H+浓度小于10-11mol/L
C. 该氨水溶液中加入NH4Cl溶液,NH3·H2O的电离能力增强
D. 滴加等浓度等体积的硫酸,得到的溶液中存在电离平衡:NH4HSO4(aq)![]() NH4+(aq)+H+(aq)+SO42-(aq)
NH4+(aq)+H+(aq)+SO42-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是(NA为阿伏加德罗常数)
A. 标准状况下,1mol SiO2所占体积约为22.4L
B. 相同质量的O2和O3含有相同数目的氧原子
C. 常温下,11.2L CO2含有分子数为0.5NA
D. 2.4g金属镁变成镁离子时失去电子的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3、MgO。工业上从铝土矿中提取铝可采用如下工艺流程:

请回答下列问题:
(1)沉淀B的成分是____________(填化学式,下同);
(2)沉淀C的成分是__________;
(3)沉淀F转化为物质M的化学方程式为 _____________________;
(4)溶液D中通入过量CO2生成沉淀F的离子方程式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77kJ·mol-1
CH3OH(g) △H3=-90.77kJ·mol-1
回答下列问题:
(1)反应Ⅱ的△H2=______________。
(2)反应Ⅲ能够自发进行的条件是__ (填“较低温度”、“ 较高温度”或“任何温度”)
(3)恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是________。
A.混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1
D.甲醇的百分含量不再变化
(4)对于反应Ⅰ,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是____。
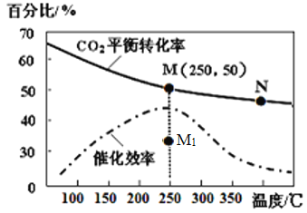
A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1
B.温度低于250℃时,随温度升高甲醇的产率增大
C.M点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(5)若在1L密闭容器中充入3molH2和1molCO2发生反应Ⅰ,250℃时反应的平衡常数K=__________;若要进一步提高甲醇积分数。可采取的措施有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入1molN2,右边充入一定量的CO时,隔板处于如图位置(保持温度不变),下列说法正确的是( )

A.右边与左边分子数之比为4:1
B.右侧CO的质量为5.6 g
C.右侧气体密度是相同条件下氢气密度的14倍
D.若改变右边CO的充入量而使隔板处于容器正中间,保持温度不变,则应充入22.4 L的CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 1mol/L的Na2CO3溶液中含有钠离子约为2×6.02×1023
B. 含氧原子数均为NA的O2和O3的物质的量之比为3:2
C. 每1mol任何物质均含有约为6.02×1023个原子
D. 含氢原子数目相同的NH3和CH4在同温同压下的体积之比为3:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了如图实验装置探究硝酸的性质,根据图示判断下列结论不正确的是

A. 试管内壁上的“黄霜”的成分是硫
B. 该实验既说明了浓硝酸具有氧化性,又说明了浓硝酸具有挥发性
C. 烧杯内氢氧化钠溶液的作用是除去尾气,防止尾气污染环境
D. 试管中浓硝酸可以用浓盐酸代替
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com