
【题目】在2A(g)+3B(g)![]() 2C(g)+D(g)中,下列表示反应速率最快的是
2C(g)+D(g)中,下列表示反应速率最快的是
A. v(A)=0.5 mol/(L·min)B. v(B)=0.6 mol/(L·min)
C. v(C)=0.4 mol/(L·min)D. v(D)=0.3 mol/(L·min)
科目:高中化学 来源: 题型:
【题目】已知伞形酮可用雷琐苯乙酮和苹果酸在一定条件下反应制得。

下列说法中正确的是
A. 一分子雷琐苯乙酮含有3个碳碳双键
B. 苹果酸的一种缩聚产物是![]()
C. 1mol伞形酮与足量NaOH溶液反应,最多可消耗2mol NaOH
D. 雷琐苯乙酮、苹果酸、伞形酮都能跟FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中可以获得淡水、食盐,并可提取镁和溴等物质。流程如下图所示:
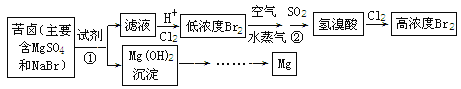
(1)用电子式表示Br2的形成过程________。提取Br2 时,第一次通入Cl2 后发生反应的离子方程式是_______;ⅦA族元素,非金属性随元素核电荷数增加而逐渐减弱的原因:同主族元素从上到下原子半径逐渐______(填“增大”或“减小”),得电子能力逐渐减弱。②中SO2表现 _________(填“氧化”“还原”“酸”“碱”)性;
(2)镁在元素周期表中的位置是________;为了实现对镁离子的富集,①中分离提纯的实验操作名称是__________;
(3)用MgCl2溶液制成无水MgCl2,加热溶液过程中,会生成Mg(OH)Cl溶液和一种酸性气体。写出该反应的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是部分矿物资源的利用及产品流程(如图),有关说法不平确的是
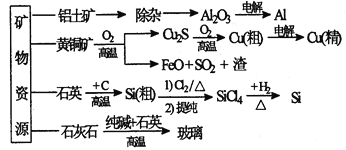
A. 粗铜电解精炼时,粗铜作阳极
B. 生产铝、铜、高纯硅及玻璃过程中都涉及氧化还原反应
C. 黄铜矿冶铜时,副产物SO2可用于生产硫酸,FeO可用作冶铁的原料
D. 粗硅制高纯硅时,提纯四氯化硅可用多次分馏的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用镁和硝基苯制取反式偶氮苯(溶解性:不溶于水,溶于醇、醚)。实验原理如下:
2![]() +4Mg+8CH3OH→
+4Mg+8CH3OH→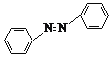 +4Mg(OCH3)2+4H2O
+4Mg(OCH3)2+4H2O
已知:①Mg(OCH3)2在水中极易水解。
②反式偶氮苯产品在紫外线照射后部分转化为顺式偶氮苯。
(1)反应中,硝基苯变为反式偶氮苯的反应属于_______________
A、取代反应 B、消去反应 C、还原反应 D、氧化反应
(2)在反应装置中,加入原料及溶剂,搅拌下加热回流。反应加入的镁条应用砂纸打磨干净的原因是_____________________________________。
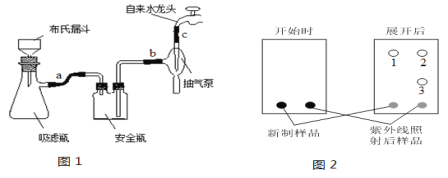
(3)反应结束后将反应液倒入冰水中,用乙酸中和至中性,即有反式偶氮苯粗产品析出,抽滤(抽滤装置如图1),滤渣用95%乙醇水溶液重结晶提纯。
①为了得到较大颗粒的晶体,加入乙酸时需要____________(填“缓慢加入”、“快速加入”)。
②抽滤过程中要洗涤粗产品,下列液体最合适的是___________。
A.乙醚 B.蒸馏水 C.95%乙醇水溶液 D.饱和NaCl溶液
③重结晶操作包括“加热溶解、趁热过滤、冷却结晶、抽滤、洗涤、干燥”。上述重结晶过程中的___________操作除去了不溶性杂质,____________操作除去了可溶性杂质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应2SO2+ O2![]() 2SO3,达到平衡时,n(SO2):n(O2):n(SO3)= 2:3:4。缩小体积,反应再次达到平衡时,n(O2)=0.8mol,n(SO3)=1.4mol,此时SO2的物质的量应是
2SO3,达到平衡时,n(SO2):n(O2):n(SO3)= 2:3:4。缩小体积,反应再次达到平衡时,n(O2)=0.8mol,n(SO3)=1.4mol,此时SO2的物质的量应是
A. 0.4mol B. 0.6mol C. 0.8mol D. 1.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室利用浓盐酸和二氧化锰制氯气,制备装置中应安装分液漏斗而不能使用长颈漏斗,有关理由叙述错误的是( )
A.防止氯气扩散到空气中造成污染
B.便于控制加入盐酸的量
C.长颈漏斗方便于添加液体
D.尽量避免氯化氢挥发到空气中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下的定容密闭容器中,发生反应2SO2(g)+ O2(g) ![]() 2SO3(g), 下列哪种情况,能表明反应达到平衡状态
2SO3(g), 下列哪种情况,能表明反应达到平衡状态
A. SO2速率是O2速率的2倍
B. SO3的浓度是O2浓度的2倍
C. SO3的质量分数保持不变
D. 单位时间内SO2消耗的浓度等于SO3生成的浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com