
【题目】从海水中可以获得淡水、食盐,并可提取镁和溴等物质。流程如下图所示:
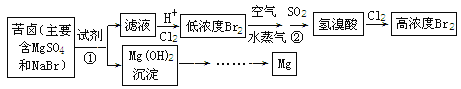
(1)用电子式表示Br2的形成过程________。提取Br2 时,第一次通入Cl2 后发生反应的离子方程式是_______;ⅦA族元素,非金属性随元素核电荷数增加而逐渐减弱的原因:同主族元素从上到下原子半径逐渐______(填“增大”或“减小”),得电子能力逐渐减弱。②中SO2表现 _________(填“氧化”“还原”“酸”“碱”)性;
(2)镁在元素周期表中的位置是________;为了实现对镁离子的富集,①中分离提纯的实验操作名称是__________;
(3)用MgCl2溶液制成无水MgCl2,加热溶液过程中,会生成Mg(OH)Cl溶液和一种酸性气体。写出该反应的化学方程式______。
【答案】![]() Cl2+2Br-==Br2+2Cl- 增大 还原性。 第三周期ⅡA族 过滤 MgCl2+H2O====Mg(OH)Cl+HCl
Cl2+2Br-==Br2+2Cl- 增大 还原性。 第三周期ⅡA族 过滤 MgCl2+H2O====Mg(OH)Cl+HCl
【解析】
(1)此小题考查了电子式的书写,元素周期律,物质的性质。Br是第四周期,第ⅦA族元素,最外层有7个电子,达到8电子稳定结构需得一个电子,则两个Br原子可形成一对共用电子对,通过共价键结合形成Br2;同主族元素从上到下原子半径逐渐增大,失电子能力增强,得电子能力减弱,元素的非金属性逐渐减弱;SO2与溴水发生氧化还原反应表现出还原性;
(2)考查原子结构与元素在周期表中位置的关系;物分离提纯的方法;
(3)考查根据已知条件书写方程式;
(1)Br是第四周期,第ⅦA族元素,最外层有7个电子,达到8电子稳定结构需得一个电子,则两个Br原子可形成一对共用电子对,通过共价键结合形成Br2的,形成过程为![]() ;提取Br2 时,第一次通入Cl2 后发生的反应是氯气氧化溴离子为溴单质,离子方程式为Cl2+2Br-==Br2+2Cl- ;ⅦA族元素,同主族元素从上到下原子半径逐渐增大,失电子能力增强,得电子能力减弱,元素的非金属性逐渐减弱;②中SO2中的S元素的化合价升高,失电子表现出还原性。本小题答案为:
;提取Br2 时,第一次通入Cl2 后发生的反应是氯气氧化溴离子为溴单质,离子方程式为Cl2+2Br-==Br2+2Cl- ;ⅦA族元素,同主族元素从上到下原子半径逐渐增大,失电子能力增强,得电子能力减弱,元素的非金属性逐渐减弱;②中SO2中的S元素的化合价升高,失电子表现出还原性。本小题答案为:![]() ;Cl2+2Br-==Br2+2Cl-;增大;还原性。
;Cl2+2Br-==Br2+2Cl-;增大;还原性。
(2)镁为12号元素,核外有12个电子,为2、8、2排布,核外有3层,最外层有2个电子,在元素周期表中的位置是第三周期ⅡA族;为了实现对镁离子的富集,①步中加入的试剂为碱性物质使镁离子生成氢氧化镁沉淀,则分离提纯的实验操作为过滤。本小题答案为:第三周期ⅡA族;过滤。
(3)用MgCl2溶液制成无水MgCl2,加热溶液过程中,会生成Mg(OH)Cl溶液和一种酸性气体,此酸性气体为HCl气体,方程式为MgCl2+H2O====Mg(OH)Cl+HCl。本小题题答案为:MgCl2+H2O====Mg(OH)Cl+HCl。


科目:高中化学 来源: 题型:
【题目】如图为不同化学元素组成的化合物示意图,下列说法正确的是( )
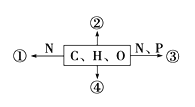
A. 若图中①为某种化合物的基本单位,则①最可能是核苷酸
B. 若②广泛分布在动物细胞内,则其一定是糖原
C. 若③为生物大分子,则其彻底水解产物最多为4种
D. 若④为重要储能物质,则动物和植物细胞都含有这种物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li—CuO二次电池的比能量高、工作温度宽,性能优异,广泛应用于军事和空间领域。
(1)Li—CuO电池中,金属锂做_______极 。
(2)比能量是指消耗单位质量的电极所释放的电量,用来衡量电池的优劣。比较Li、Na、Al分别作为电极时比能量的大小:____________。
(3)通过如下过程制备CuO。
![]()
①过程Ⅰ,H2O2的作用是__________________。
②过程Ⅱ产生Cu2(OH)2CO3的离子方程式是_____________________。
③过程Ⅱ,将CuSO4溶液加到Na2CO3溶液中,研究二者不同物质的量之比与产品纯度的关系(用测定铜元素的百分含量来表征产品的纯度),结果如下:
已知:Cu2(OH)2CO3中铜元素的百分含量为57.7%。

二者比值为1:0.8时,产品中可能含有的杂质是_____________,产生该杂质的原因是_________________________________。
④ 过程Ⅲ反应的化学方程式是_________________________。
(4)Li—CuO二次电池以含Li+的有机溶液为电解质溶液,其工作原理示意如下。放电时,正极的电极反应式是______________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.石油、煤、天然气都属于化石燃料
B.油脂在碱性条件下的水解反应又称为皂化反应
C.分子式为(C6H10O5)n的淀粉和纤维素互为同分异构体
D.麦芽糖是还原性糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置(加热装置已略去)或操作合理的是( )
|
|
|
|
A.吸收氨气并防倒吸 | B.用SO2与Ba(NO3)2反应获得BaSO3沉淀 | C.分离溴苯和苯的混合物 | D. 验证HCl的溶解性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组拟用铅蓄电池进行电絮凝净水的实验探究,设计的实验装置如图所示,下列叙述正确的是( )

A. Y 的电极反应: Pb-2e- = Pb2+
B. 铅蓄电池工作时SO42-向 Y 极移动
C. 电解池的反应仅有2Al+6H2O![]() 2Al(OH)3+3H2↑
2Al(OH)3+3H2↑
D. 每消耗 103.5 gPb ,理论上电解池阴极上有0.5 molH2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置可制取 H2,两个电极均为惰性电极,c 为阴离子交换膜。下列叙述正确的是

A. a 为电源的正极
B. 工作时,OH向左室迁移
C. 右室电极反应为:C2H5OH+H2O4e=CH3COO+5H+
D. 生成 H2 和 CH3COONa 的物质的量之比为 2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+3B(g)![]() 2C(g)+D(g)中,下列表示反应速率最快的是
2C(g)+D(g)中,下列表示反应速率最快的是
A. v(A)=0.5 mol/(L·min)B. v(B)=0.6 mol/(L·min)
C. v(C)=0.4 mol/(L·min)D. v(D)=0.3 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)![]() NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g)![]() H2(g)+I2(g)。
H2(g)+I2(g)。
达到平衡时,c(H2)=0.5mol·L-1,c(HI)=3mol·L-1,则此温度下反应①的平衡常数为
A. 9 mol2·L-2B. 12 mol2·L-2C. 16 mol2·L-2D. 20 mol2·L-2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com