
【题目】在第二次世界大战中拯救了成千上万士兵的生命,被誉为与原子弹、雷达齐名的当时三大发明之一的药物是( )
A.青霉素
B.阿司匹林
C.麻黄碱
D.抗酸药
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】将锌片和银片用导线相连浸入稀硫酸中组成原电池.该电池中负极发生反应(填“氧化”或“还原”);溶液中的H+移向(填“正极”或“负极”).若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质变质量为47g,试计算产生氢气的体积(标准状况) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知C(s)+H2O(g)=CO(g)+H2(g) ΔH=+135kJ·mol-1;2C(s)+O2(g)=2CO(g) ΔH=-226 kJ·mol-1。断开1 mol H—H键、O=O键分别需要吸收436 kJ、498 kJ的热量,则断开1 molO—H键需要吸收的热量为( )
A. 462 kJ B. 469 kJ C. 362 kJ D. 466.5 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】血红蛋白(Hb)和肌红蛋白(Mb)分别存在于血液和肌肉中,都能与氧气结合,与氧气的结合度a(吸附O2的Hb或Mb占总Hb或Mb的比例)和氧分压p(O2)密切相关。
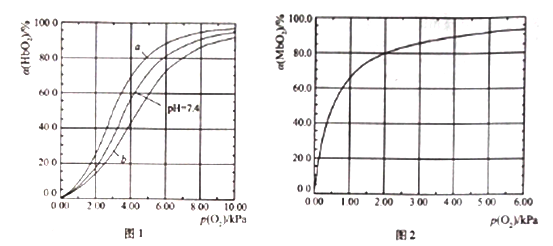
I .Hb与氧气的结合能力还受到c(H+)的影响,平衡如下:
HbO2(aq)+H+(aq) ![]() HbH+(aq)+O2(g) (反应①)。37℃,PH分别为7.2、7.4、7.6 时氧分压p(O2)和达平衡时的结合度的关系如图1
HbH+(aq)+O2(g) (反应①)。37℃,PH分别为7.2、7.4、7.6 时氧分压p(O2)和达平衡时的结合度的关系如图1
(1)图1中pH=7.6时的曲线为______ (填“a”或“b”)。
(2)血液中还存在平衡:CO2+H2O![]() H2CO3
H2CO3![]() H++HCO3-(反应②),用平衡理论解释肺部高氧分压有利于CO2排出体外的原因___________。
H++HCO3-(反应②),用平衡理论解释肺部高氧分压有利于CO2排出体外的原因___________。
II.Mb与氧气结合的平衡如下:Mb(aq)+O2(g) ![]() MbO2(aq)(反应③),37℃时,氧分压p(O2)和达平衡时的结合度的关系如图2。
MbO2(aq)(反应③),37℃时,氧分压p(O2)和达平衡时的结合度的关系如图2。
(3)若肌肉中Mb的初始浓度为c0 mol/L,结合度达到50%所需的时间为t min,此段时间内用MbO2表示的平均反应速率为____________。
(4)图2中a随p(O2)增大而增大的原因是______________。
(5) Mb与氧气结合的平衡常数的表达式K=![]() ,计算37℃时K=____________。
,计算37℃时K=____________。
(6) Mb与氧气结合达平衡时结合度a=____________ [用含p(O2)和K的代数式表示]。
人正常呼吸时,温度约为37℃,空气中氧分压约为20.0kPa,计算此时Mb与氧气的最大结合度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二铬可用作搪瓷、陶瓷、人造革、建筑材料的着色剂。由高碳铬铁合金(含Cr、Fe及C)制备三氧化二铬的工艺流程如下:

已知:Cr(OH)3是两性氢氧化物,草酸亚铁为微溶物。
回答下列问题:
(1)步骤Ⅰ浸取时,为提高浸取速率,除将高碳铬铁合金制成粉末外,还可采取的措施是__________________________(写一点);浸取铬时反应的离子方程式为_______________。
(2)步骤Ⅱ滤渣返回再次浸取的目的是_____________________________________________。
(3)步骤Ⅲ除铁时,溶液的pH对铁的去除率影响如图1所示:

图1 图2
pH小于2.3时,铁去除率低,其原因是_______________________________________。
(4)步骤Ⅳ能说明沉淀已洗涤干净的操作是________________________________________。
(5)步骤Ⅴ沉铬时,生成Cr(OH)3的化学方程式为_____________________________;沉铬时,溶液pH与铬的回收率关系如图2所示,当pH>8.5时,pH越大,铬的回收率越低,其可能原因是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5 mol A和4 mol B充入0.4L密闭容器中发生2A(g)+B(g)![]() mD(g)+E(g),经过5min后达到化学平衡,此时测得D为2 mol。又知5min内用E表示的平均反应速率为0.5 mol·L-1·min-1,下列结论正确的是( )
mD(g)+E(g),经过5min后达到化学平衡,此时测得D为2 mol。又知5min内用E表示的平均反应速率为0.5 mol·L-1·min-1,下列结论正确的是( )
A. m值为1
B. B的转化率为25%
C. 平衡时混合物总物质的量为8mol
D. 5min内用A表示的平均反应速率为0.4 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一氧化碳与水蒸气的反应为:CO(g)+H2O (g)![]() CO2 (g)+H2 (g),在427℃时的平衡常数是9.4。回答下列问题:
CO2 (g)+H2 (g),在427℃时的平衡常数是9.4。回答下列问题:
(1)氢气作为燃料与汽油相比,其优点是____________________________________________(答一条即可)。
(2)800℃时,在容积为2.0L的密闭容器中充入2.0mlCO(g)和3.0molH2O(g),保持温度不变,4min后
反应达到平衡,测得CO的转化率为60%。
①4min内H2的平均化学反应速率为__________mol/(L·min)。
②800℃时该反应的平衡常数值为__________。请结合题中的信息判断该反应的△H__________0。
(3)一定条件下,设起始加入二氧化碳和氢气且![]() = Z,在恒压下.平衡时CO2的体积分数φ(CO2) 与Z和T(温度)的关系如图所示,下列说法正确的是(_____)
= Z,在恒压下.平衡时CO2的体积分数φ(CO2) 与Z和T(温度)的关系如图所示,下列说法正确的是(_____)

A.该反应的焓变△H>0
B.图中Z的大小为b>3>a
C.图中x 点对应的平衡混合物中![]() = 3
= 3
D.温度不变时,图中x点对应的平衡在加压后φ(CO2)减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com