
| 0.2505g |
| 167g/mol |
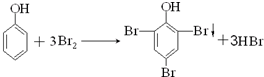 ,
,| 1×10-2moL×94g/mol |
| 1.000g |


科目:高中化学 来源: 题型:

| HCL |
| C2H5OH |
| H2O |
| H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、26.0kJ |
| B、51.9kJ |
| C、155.8kJ |
| D、467.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、20mL 2mol/L Mg(NO3)2 |
| B、100mL 2.5mol/L NaNO3 |
| C、25mL 1.0mol/L Al(NO3)3 |
| D、30mL 2.5mol/L NH4NO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2FeO4只是氧化产物 |
| B、Na2O2具有杀菌消毒作用 |
| C、1mol FeSO4发生反应时,共有4mol电子转移 |
| D、Na2FeO4处理水时除有杀菌作用外其生成物还有净水作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H、D、T表示三种氢原子 |
| B、原子最外层少于4个电子的元素均是金属元素 |
| C、稀有气体元素最外层电子数均为8个 |
| D、目前人们已发现了5000多种核素,说明发现了5000多种元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com