
【题目】已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O。现用如图装置进行电解实验,测得当铅蓄电池中转移0.4mol电子时,铁电极的质量减少11.2g.(铁的相对原子质量:56)请回答下列问题:
2PbSO4+2H2O。现用如图装置进行电解实验,测得当铅蓄电池中转移0.4mol电子时,铁电极的质量减少11.2g.(铁的相对原子质量:56)请回答下列问题:
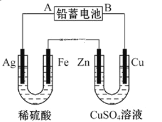
①A是铅蓄电池的__________极,
②Ag电极的电极反应式是__________,该电极的电极产物有__________g.
③Cu电极的电极反应式是__________,CuSO4溶液的浓度__________(填“减小”“增大”或“不变”)。
④如图表示电解进行过程中某个物理量x随时间t的变化曲线,其中曲线Ⅰ表示左侧U形管中的变化,曲线Ⅱ表示右侧U形管中的变化,则x表示(_______)
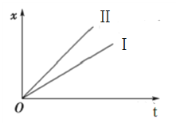
A.U形管中产生的气体的体积 B.U形管中阳极质量的减少量C.U形管中阴极质量的增加量
【答案】负 2H++2e-=H2↑ 0.4 Cu-2e-=Cu2+ 不变 B
【解析】
已知铅蓄电池中转移0.4mol电子时,铁电极的质量减少11.2g,则左边电解池中Fe为阳极,Ag为阴极,则铅蓄电池A为负极,B为正极,据此解答。
①分析可知,A是铅蓄电池的负极,故答案为:负;
②Ag电极为电解池的阴极,氢离子在Ag电极得电子生成氢气,电极反应式为2H++2e-=H2↑,转移0.4mol电子时,生成0.2mol氢气,即0.2mol×2g/mol=0.4g,故答案为:2H++2e-=H2↑;0.4;
③Cu与铅蓄电池的正极相连,为阳极,铜失电子生成铜离子,电极反应式为Cu-2e-=Cu2+,Zn为阴极,溶液中的铜离子在阴极得电子生成铜,则溶液中的铜离子浓度不变,SO42-没有参与反应,浓度也不变,所以,CuSO4的浓度不变,故答案为:Cu-2e-=Cu2+;不变;
④A.右侧U形管中无气体生成,与图象不符,A错误;
B.左侧U形管中阳极为Fe,发生反应为:Fe-2e-=Fe2+,右侧U形管中阳极为Cu,发生反应为:Cu-2e-=Cu2+,随反应时间的增大,质量减少量增大,且根据![]() 可知,相同时间内,Fe减少的质量小于Cu减小的质量,与图象相符,B正确;
可知,相同时间内,Fe减少的质量小于Cu减小的质量,与图象相符,B正确;
C.稀硫酸电解池中阴极产生氢气,阴极的质量不变,与图象不符,C错误;
故答案为:B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】目前生产聚氯乙烯的方法是先使乙烯与氯气和氧气在一定条件下反应生成氯乙烯和水,再进一步合成聚氯乙烯。请回答
(1)请写出上述两个过程所发生反应的化学方程式:①____________________________,②__________________________________________。
(2)聚氯乙烯是一种可燃物,火灾中聚氯乙烯燃烧会产生有害气体,其主要成分可能是_________;若在火灾现场,为了防止气体中毒,应采取的防护措施是__________________________________________。
(3)聚氯乙烯___________(填“可以”或“不可以”)用于制作食品包装袋,原因是______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟在自然界中常以CaF2的形式存在。
(1)下列关于CaF2的表述正确的是________。
a.Ca2+与F-间仅存在静电吸引作用
b.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
c.阴阳离子比为2∶1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是_______________(用离子方程式表示)。已知AlF![]() 在溶液中可稳定存在。
在溶液中可稳定存在。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为________,其中氧原子的杂化方式为________。
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)===2ClF3(g) ΔH=-313 kJ·mol-1,F—F键的键能为159 kJ·mol-1,Cl—Cl键的键能为242 kJ·mol-1,则ClF3中Cl—F键的平均键能为________kJ·mol-1。ClF3的熔、沸点比BrF3的________(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A、C原子的L能层中都有两对未成对的电子,C、D同主族。E、F都是第四周期元素,E原子核外有4个未成对的电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
(1)基态D原子中,电子占据的最高能层符号________,该能层具有的原子轨道数为_________。
(2)E2+离子的价层电子排布图是__________,F原子的电子排布式是__________。
(3)A元素的最高价氧化物对应的水化物中心原子采用的轨道杂化方式为______,B元素的气态氢化物的VSEPR模型为___________。
(4)化合物AC2、B2C和阴离子DAB-互为等电子体,它们的结构相似,DAB-的电子式为_____________
(5)配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程式为________________________
(6)某种化合物由D、E、F三种元素组成,其晶胞如图所示,其化学式为_____。
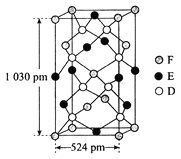
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,且所含碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图所示:
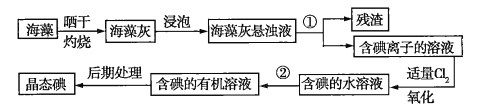
(1)指出制取碘的过程中有关实验操作的名称:①__________,②__________。
(2)操作②中可供选择的有机试剂是_________(填序号)。
A.甲苯、酒精 B.四氯化碳、苯 C.汽油、乙酸 D.汽油、甘油
(3)现需做使海藻灰中的碘离子转化为有机溶液中的碘单质的实验,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、药品,尚缺少的玻璃仪器是__________、___________。
(4)要从碘的苯溶液中提取碘和回收苯,还需要经过蒸馏操作。进行蒸馏操作时,需使用水浴加热,目的是__________,最后晶态碘在________中聚集。
查看答案和解析>>
科目:高中化学 来源: 题型:
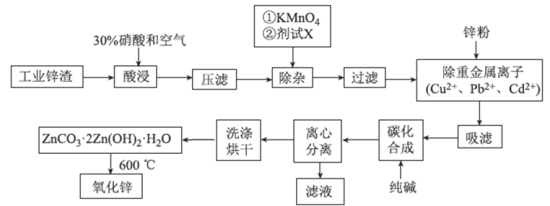
【题目】氧化锌工业品广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃和电子等行业,随着工业的飞速发展,我国对氧化锌的需求量日益增加,成为国民经济建设中不可缺少的重要基础化工原料和新型材料。用工业含锌废渣![]() 主要成分为ZnO,还含有铁、铝、铜的氧化物,
主要成分为ZnO,还含有铁、铝、铜的氧化物,![]() 、
、![]() 、
、![]() 等
等![]() 制取氧化锌的工艺流程如图所示:
制取氧化锌的工艺流程如图所示:
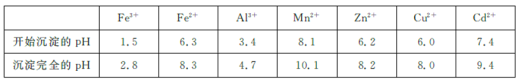
已知:相关金属离子![]() 生成氢氧化物沉淀的pH如下表所示:
生成氢氧化物沉淀的pH如下表所示:
回答下列问题:
![]() 为调节溶液的pH,则试剂X为_________
为调节溶液的pH,则试剂X为_________![]() 填化学式
填化学式![]() ,
,
![]() 除杂时加入高锰酸钾的作用是_________,发生反应的离子方程式为___________。
除杂时加入高锰酸钾的作用是_________,发生反应的离子方程式为___________。
![]() “过滤”所得滤渣的主要成分是_________
“过滤”所得滤渣的主要成分是_________![]() 填化学式
填化学式![]() 。
。
![]() 写出“碳化合成”的化学方程式:________;“碳化合成”过程需纯碱稍过量,请设计实验方案证明纯碱过量:_________。
写出“碳化合成”的化学方程式:________;“碳化合成”过程需纯碱稍过量,请设计实验方案证明纯碱过量:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为某城市某日空气质量报告,下列叙述与报告内容不相符的是

A. 该日空气首要污染物是PM10
B. 该日空气质量等级属于中度污染
C. 污染物NO2、CO可能主要来源于机动车尾气
D. PM2.5、PM10指的是悬浮颗粒物,会影响人体健康
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中发生如下反应:X(g)+3Y(g) ![]() 2Z(g) ΔH<0,下图表示该反应的速率(v)随时间(t)变化的关系,t1、t3、t4时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中不正确的是( )
2Z(g) ΔH<0,下图表示该反应的速率(v)随时间(t)变化的关系,t1、t3、t4时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中不正确的是( )
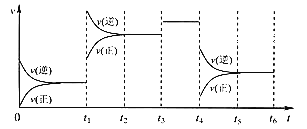
A. t1时升高了温度 B. t3时加入了催化剂
C. t4时降低了压强 D. 在t3~t4时间内,X的体积分数最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有A、B、C、D、E、F六种装置,如图所示。(胶塞、导管可自由选用)


(1)写出①~④的仪器名称:①__________,②__________,③________,④________。
(2)实验室制取并收集氧气时应选择________和________相连接,制取并收集氢气时应选择________和________相连接。
(3)做木炭还原氧化铜并检验生成气体的实验,应选择________和________相连接,检验气体时观察到的实验现象是________。
(4)制取氢气并做还原氧化铜的实验,应选择________和________装置,实验结束时应先停止加热,待试管冷却后,再停止通氢气,其原因是_________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com