
【题目】已知H2A在水中存在以下平衡:H2A![]() H++HA-,HA-
H++HA-,HA-![]() H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)NaHA溶液_______(填“显酸性”“显碱性”“显中性”或“酸碱性无法确定”),原因是_________________________________________________________。
(2)某温度下,向0.1 mol·L-1的NaHA溶液中滴入0.1 mol·L-1KOH溶液至中性,此时溶液中以下关系一定正确的是__________(填字母)。
A.c(H+)·c(OH-)=1×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05 mol·L-1
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s) ![]() Ca2+(aq)+A2-(aq) ΔH>0。
Ca2+(aq)+A2-(aq) ΔH>0。
①温度升高时,Ksp_________(填“增大”“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+)_________,原因是_____________________ (用文字和离子方程式说明)。
(4)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式:__________________________________________________。
【答案】酸碱性无法确定 不能确定HA-的电离程度和水解程度的大小 BC 增大 增大 加盐酸发生反应:A2-+H+![]() HA- A2-浓度减小 CaA的溶解平衡向右移动 n(Ca2+)显著增大 。而溶液体积变化不大所以c(Ca2+)增大 CaA(s)+Cu2+(aq)
HA- A2-浓度减小 CaA的溶解平衡向右移动 n(Ca2+)显著增大 。而溶液体积变化不大所以c(Ca2+)增大 CaA(s)+Cu2+(aq) ![]() Ca2+(aq)+CuA(s)
Ca2+(aq)+CuA(s)
【解析】
(1) NaHA溶液中存在HA-的电离平衡和水解平衡,HA-电离呈酸性、HA-水解呈碱性;(2) A.温度不确定,所以水的离子积常数不能确定;B.根据电荷守恒c(Na+)+c(K+)+ c(H+) =c(HA-)+2c(A2-)+ c(OH-);0.1 mol·L-1的NaHA溶液中与0.1 mol·L-1KOH溶液等体积混合时,溶质是Na2A、K2A,此时溶液呈碱性,所以向0.1 mol·L-1的NaHA溶液中滴入0.1 mol·L-1KOH溶液至中性时,NaHA的物质的量大于KOH; 0.1 mol·L-1的NaHA溶液中滴入0.1 mol·L-1KOH溶液,根据物料守恒分析c(Na+)+c(K+);(3) ① CaA(s) ![]() Ca2+(aq)+A2-(aq) ΔH>0,升高温度平衡正向移动,离子浓度增大;②滴加少量浓盐酸,H+与A2-生成HA-,A2-浓度减小, CaA(s)
Ca2+(aq)+A2-(aq) ΔH>0,升高温度平衡正向移动,离子浓度增大;②滴加少量浓盐酸,H+与A2-生成HA-,A2-浓度减小, CaA(s) ![]() Ca2+(aq)+A2-(aq)平衡正向移动;(4)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质CuA,发生沉淀转化。
Ca2+(aq)+A2-(aq)平衡正向移动;(4)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质CuA,发生沉淀转化。
(1) NaHA溶液中存在HA-的电离平衡和水解平衡,HA-电离呈酸性、HA-水解呈碱性,由于不能确定HA-的电离程度和水解程度的大小,所以溶液酸碱性无法确定;(2)A.温度不确定,所以水的离子积常数不能确定,所以某温度下,c(H+)·c(OH-)不一定等于1×10-14,故不选A;B.根据电荷守恒c(Na+)+c(K+)+ c(H+) =c(HA-)+2c(A2-)+ c(OH-),溶液呈中性c(H+)=c(OH-),所以c(Na+)+c(K+)=c(HA-)+2c(A2-),故选B;向0.1 mol·L-1的NaHA溶液中滴入0.1 mol·L-1KOH溶液至中性时,NaHA的物质的量大于KOH,所以c(Na+)>c(K+),故选C;V1L 0.1 mol·L-1的NaHA溶液中滴入V2L 0.1 mol·L-1KOH溶液,根据物料守恒,c(Na+)+c(K+)=![]() mol·L-1,故不选D;(3) ① CaA(s)
mol·L-1,故不选D;(3) ① CaA(s) ![]() Ca2+(aq)+A2-(aq) ΔH>0,升高温度平衡正向移动,离子浓度增大,所以温度升高时Ksp增大;②滴加少量浓盐酸,H+与A2-生成HA-,A2-浓度减小, CaA(s)
Ca2+(aq)+A2-(aq) ΔH>0,升高温度平衡正向移动,离子浓度增大,所以温度升高时Ksp增大;②滴加少量浓盐酸,H+与A2-生成HA-,A2-浓度减小, CaA(s) ![]() Ca2+(aq)+A2-(aq)平衡正向移动,所以c(Ca2+)增大;(4)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质CuA,发生沉淀转化,反应离子方程式是CaA(s)+Cu2+(aq)
Ca2+(aq)+A2-(aq)平衡正向移动,所以c(Ca2+)增大;(4)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质CuA,发生沉淀转化,反应离子方程式是CaA(s)+Cu2+(aq)![]() Ca2+(aq)+CuA(s)。
Ca2+(aq)+CuA(s)。


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y原子的最外层电子数是其电子层数的3倍。下列说法正确的是( )
![]()
A.Y和Z的最高正化合价相同
B.气态氢化物的热稳定性:XH3<H2Y<H2Z
C.原子半径的大小:r(W)>r(Y)>r(Z)
D.W的最高价氧化物对应水化物的酸性比Z的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列浓度关系正确的是
A.0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L的Ba(OH)2溶液至沉淀刚好完全:c (NH4+)>c (OH-)>c (SO42-)>c (H+)
B.0.1 mol/L的KOH溶液中通入标准状况下的CO2气体3.36 L,所得溶液中:c (K+)+c (H+)=c (CO32-)+c (HCO3-)+c (OH-)
C.0.1 mol/L的NaOH溶液与0.2 mol/L的HCN溶液等体积混合,所得溶液呈碱性:c (HCN)>c (Na+)>c (CN-)>c (OH-)>c (H+)
D.pH相同的NaOH溶液、CH3COONa溶液、Na2CO3溶液、NaHCO3溶液的浓度:c (NaOH)<c (CH3COONa)<c (NaHCO3)<c (Na2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:
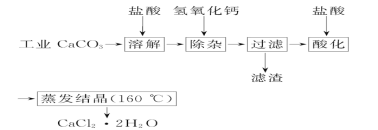
(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+。检验Fe(OH)3 是否沉淀完全的试验操作是_________________。
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③________________________。
(3)测定样品中Cl-含量的方法是:a.称取0.750 0 g样品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用0.050 00 mol· L-1 AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
①上述测定过程中需要溶液润洗的仪器有_______________________________。
②计算上述样品中CaCl2·2H2O的质量分数为________________。
③若用上述办法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因是________________________;______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
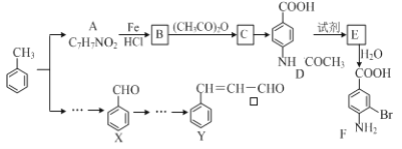
【题目】某研究小组以甲苯为主要原料,采用以下路线合成医药中间体F和Y。
已知:①![]()
![]()
![]()
②![]()
③CH3COOH+CH3COOH→(CH3CO)2O+H2O
请回答下列问题:
(1)下列有关F的说法正确的是______________。
A.分子式是C7H7NO2Br B.F即能与HCl又能与NaOH应生成盐
C.能发生取代反应和缩聚反应 D.1 mol的 F最多可以和2 mol NaOH反应
(2)C→ D的反应类型是 _____。
(3)在合成F的过程中,B→C步骤不能省略,理由是_____________________。
(4)D→E反应所需的试剂是 ___________________。
(5)写出同时符合下列条件的A的同分异构体的结构简式(写出其中1个)_________________。
①苯环上只有两种不同化学环境的氢原子②分子中含有-CHO
(6)利用已知信息,以X和乙烯为原料可合成Y,请设计合成路线(无机试剂及溶剂任选)。___________ 注:合成路线的书写格式参照如下示例流程图:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写不正确的是
A.用两块铜片作电极电解盐酸:Cu + 2H+ ![]() H2↑ + Cu2+
H2↑ + Cu2+
B.NaOH溶液与足量的Ca(HCO3)2溶液反应:2HCO3- + 2OH- + Ca2+==CaCO3↓+ 2H2O
C.等物质的量的FeBr2和Cl2在溶液中的反应:2Fe2+ + 2Br - + 2Cl2==2Fe3+ + Br2 + 4Cl -
D.氨水吸收少量的二氧化硫:2NH3·H2O + SO2==2NH4+ +SO32- + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有短周期主族元素X、Y、Z、R、T。R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡,五种元素的原子半径与原子序数的关系如图所示,下列推断正确的是

A. 原子半径和离子半径均满足:Y<Z
B. Y的单质易与R、T的氢化物反应
C. 最高价氧化物对应的水化物的酸性:T<R
D. 由X、R、Y、Z四种元素组成的化合物水溶液一定显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能。图乙为电解氯化铜溶液的实验装置的一部分。下列说法中不正确的是
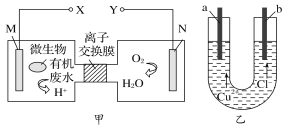
A. a极应与X连接
B. N电极发生还原反应,当N电极消耗11.2 L(标准状况下) O2时,则a电极增重64 g
C. 不论b为何种电极材料,b极的电极反应式一定为2Cl--2e-=Cl2↑
D. 若废水中含有乙醛,则M极的电极反应为:CH3CHO+3H2O-10e-=2CO2↑+10H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.含有1mol原子的氢气在标准状况下的体积约为22.4 L
B.25 ℃,1.01×105Pa,64 g SO2中含有的原子数为3NA
C.1 mol/L的Na2SO4溶液含Na+数为2 NA
D.标准状况下,11.2 L H2O含有的分子数为9 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com