
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y原子的最外层电子数是其电子层数的3倍。下列说法正确的是( )
![]()
A.Y和Z的最高正化合价相同
B.气态氢化物的热稳定性:XH3<H2Y<H2Z
C.原子半径的大小:r(W)>r(Y)>r(Z)
D.W的最高价氧化物对应水化物的酸性比Z的强
【答案】D
【解析】
X、Y、Z、W均为短周期元素,Y原子的最外层电子数是次外层电子数的3倍,次外层电子数为2,最外层电子数为6,则Y为O元素;由图中的位置可知,X为N,Z为S,W为Cl,然后利用元素周期律及物质的性质来解答。
A.Y为O元素,氧元素一般没有正化合价,故A错误;
B.X为N,Y为O,Z为S,非金属性越强,简单气态氢化物的稳定性越强,非金属性O>N>S,则气态氢化物的热稳定性: H2Y>XH3>H2Z,,故B错误
C.Y为O,Z为S,W为Cl,同周期元素从左到右,原子半径逐渐减小,则原子半径:r(W) <r(Y),故C错误;
D.W为Cl元素,最高价含氧酸HClO4是最强的含氧酸,故D正确;
答案选D。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】将气体X通入溶液A(如下图,尾气吸收装置略)中,实验现象能够支持结论的是
选项 | 气体X | 溶液A及反应现象 | 结论 |
A. | 乙醇与浓硫酸共热170℃产生的气体 | Br2的水溶液由橙黄色变为无色 | 乙烯与溴发生反应 |
B. | 电石与饱和食盐水反应产生的气体 | KMnO4酸性溶液紫色逐渐变浅 | 乙炔被高锰酸钾酸性溶液氧化 |
C. | 溴乙烷与氢氧化钠醇溶液共热生成的气体 | Br2的水溶液由橙黄色变为无色 | 乙烯与溴发生反应 |
D. | 碳酸钠固体与醋酸溶液反应产生的气体 | 苯酚钠溶液中出现白色沉淀 | 碳酸的酸性强于苯酚 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组进行下列实验:
①将0.1 mol·L-1 MgCl2溶液和0.5 mol·L-1 NaOH溶液等体积混合得到浊液
②取少量①中浊液,滴加0.1 mol·L-1 FeCl3溶液,出现红褐色沉淀
③将①中浊液过滤,取少量白色沉淀,滴加0.1 mol·L-1 FeCl3溶液,白色沉淀变为红褐色沉淀
④另取少量白色沉淀,滴加饱和NH4Cl溶液,沉淀溶解
下列说法中不正确的是( )
A. 将①中所得浊液过滤,所得滤液中含少量Mg2+
B. ①中浊液中存在沉淀溶解平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq)
Mg2+(aq)+2OH-(aq)
C. 实验②和③均能说明Fe(OH)3比Mg(OH)2难溶
D. NH4Cl溶液中的NH4+可能是④中沉淀溶解的原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料、防腐等工业,它不溶于H2SO4、HNO3和醇,微溶于水,可溶于浓盐酸和氨水,在潮湿空气中易水解氧化成绿色的碱式氯化铜[Cu2(OH)3Cl]。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:

(1)写出溶解过程中发生的氧化还原反应的离子方程式:_________
(2)还原过程中发生的主要反应的离子方程式:_________。
(3)析出的CuCl晶体水洗后要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2h,冷却密封包装。70℃真空干燥、密封包装的原因是__________。
(4)写出氯化亚铜在空气中被氧化的化学方程式________
(5)如图是各反应物在最佳配比条件下,反应温度对CuCl产率影响.由图可知,溶液温度控制在60℃时,CuCl产率能达到94%,当温度高于65℃时,CuCl产率会下降,其原因可能是___。

(6)以碳棒为电极电解CuCl2溶液也可得到CuCl,写出电解时阴极上发生的电极反应式:____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1mol/L,体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液pH的关系如图所示,下列说法正确的是

A. Ka=1×10-6
B. b点时,c(B+)=c(A-)
C. c点时,![]() 随温度升高而增大
随温度升高而增大
D. a→c过程中水的电离程度始终增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】传统接触法制取硫酸能耗大,污染严将燃料电池引人硫酸生产工艺可有效解决能耗和环境污染问题,同时提供电能。以燃料电池为电源电解硫酸铜溶液的工作原理示意图如下所示。
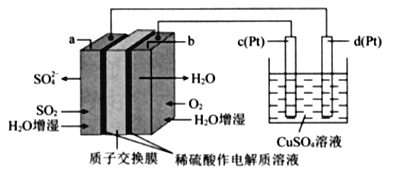
下列说法不正确的是( )
A. b极为正极,电极反应式为O2+4H++4e-=2H20
B. H+由a极通过质子交换膜向b极移动
C. 该燃料电池的总反应式为2SO2+O2+2H2O=2H2SO4
D. 若a极消耗2.24 L(标准状况)SO2,理论上c极,有6.4g铜析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与完成相关实验问题讨论。
(实验目的)制取乙酸乙酯
(实验原理)甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯。
(装置设计)甲、乙、丙三位同学分别设计了下列三套实验装置:

根据分析回答:(1)三位同学设计的装置中最不合理的是____(选填“甲”或“乙”或“丙”),原因是_________________。
(实验步骤)
a.按所选择的装置组装仪器,在试管①中先加入3mL乙醇,并在摇动下缓缓加入2mL浓硫酸充分摇匀,冷却后再加入2mL冰醋酸;
b.将试管固定在铁架台上;
c.在试管②中加入适量的饱和Na2CO3溶液;
d.用酒精灯对试管①加热;
e.当观察到试管②中有明显现象时停止实验。
(2)试管①中加入浓硫酸的作用是______________________________
(3)该实验中长导管的作用是___________________。
(4)试管②中饱和Na2CO3溶液的作用是_______________;可否用NaOH溶液代替Na2CO3溶液?_____(填“是”或“否”),理由是用化学方程式回答_______________。
(5)写出试管①中乙醇工业制取的化学方程式________________________________;
II.实验室制备硝基苯的主要步骤如下:
a、配制一定比例的浓H2SO4与浓HNO3的混合酸,加入反应器中;
b、向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀;
c、在55~60℃下发生反应,直至反应结束;
d、除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤;
e、将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯净硝基苯。请填写下列空白:
①制备硝基苯的反应类型是________________。
②配制一定比例的浓H2SO4与浓HNO3的混合酸时,操作的注意事项是:_____。
③步骤d中洗涤、分离粗硝基苯应使用的仪器是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)甲基的电子式___________。
(2)有下列六组物质:属于同系物的是______,属于同分异构体是______,属于同种物质的是______。(填序号)
A. 与
与 B.
B.![]() 与
与![]()
C.![]() 与
与![]() D.
D.![]() 与
与![]()
E.ClC(CH3)3与(CH3)2CHCH2Cl F.![]() 与CH3﹣CH2Cl.
与CH3﹣CH2Cl.
(3)写出由甲苯制备TNT的化学反应方程式___________。
(4)相对分子质量为72且只有一种一氯代物的烷烃的结构简式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2A在水中存在以下平衡:H2A![]() H++HA-,HA-
H++HA-,HA-![]() H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)NaHA溶液_______(填“显酸性”“显碱性”“显中性”或“酸碱性无法确定”),原因是_________________________________________________________。
(2)某温度下,向0.1 mol·L-1的NaHA溶液中滴入0.1 mol·L-1KOH溶液至中性,此时溶液中以下关系一定正确的是__________(填字母)。
A.c(H+)·c(OH-)=1×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05 mol·L-1
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s) ![]() Ca2+(aq)+A2-(aq) ΔH>0。
Ca2+(aq)+A2-(aq) ΔH>0。
①温度升高时,Ksp_________(填“增大”“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+)_________,原因是_____________________ (用文字和离子方程式说明)。
(4)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式:__________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com