
【题目】按要求填空:
(1)甲基的电子式___________。
(2)有下列六组物质:属于同系物的是______,属于同分异构体是______,属于同种物质的是______。(填序号)
A. 与
与 B.
B.![]() 与
与![]()
C.![]() 与
与![]() D.
D.![]() 与
与![]()
E.ClC(CH3)3与(CH3)2CHCH2Cl F.![]() 与CH3﹣CH2Cl.
与CH3﹣CH2Cl.
(3)写出由甲苯制备TNT的化学反应方程式___________。
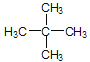
(4)相对分子质量为72且只有一种一氯代物的烷烃的结构简式___________。
【答案】![]() C E A
C E A 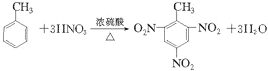
【解析】
(1)甲基的结构简式为-CH3;
(2)同系物:结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物;同分异构体:具有相同的分子式,但具有不同结构的化合物互称为同分异构体;根据定义并结合有机物结构简式进行对比;
(3)甲苯与浓硝酸在浓硫酸作催化剂并加热可生成三硝基甲苯(TNT);
(4)该有机物为烷烃,可设该有机物的分子式为CnH2n+2,根据其相对分子质量为72,求出该有机物的分子式,因该有机物的一氯代物只有一种结构,故结构需要高度对称,写出其结构简式。
(1)甲基的结构简式为-CH3,故其电子式为:![]() ;
;
(2)A.其化学式相同,结构相同,属于同一种物质;B.其分子式不同,碳原子个数相同,属于不同物质,且不互为同分异构体和同系物;C.其结构相似,且分子组成上相差1个CH2,属于同系物;D.其分子式不相同,属于不同物质,且不互为同分异构体和同系物;E.其分子式相同,其结构不同,互为同分异构体;F.其分子式不同,且不互为同分异构体和同系物;故属于同系物的是C;属于同分异构体的是E;属于同种物质的是A;
(3)甲苯与浓硝酸在浓硫酸作催化剂并加热可生成三硝基甲苯(TNT),其化学反应方程式为: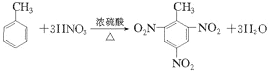 ;
;
(4)该有机物为烷烃,可设该有机物的分子式为CnH2n+2,根据其相对分子质量为72,即12n+2n+2=72(n为正整数),求得n=5,该有机物的分子式为C5H12,因该有机物的一氯代物只有一种结构,故其结构为: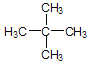 。
。


科目:高中化学 来源: 题型:
【题目】用盐酸标准液滴定未知浓度的NaOH溶液,下列各操作中会引起实验误差的是( )
A. 滴定前酸式滴定管需用盐酸标准液润洗
B. 用蒸馏水洗净锥形瓶后,立即装入一定体积的NaOH溶液后进行滴定
C. 往盛有20.00 mL NaOH溶液的锥形瓶中,滴入几滴酚酞指示剂后进行滴定
D. 用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,然后装入一定体积的NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y原子的最外层电子数是其电子层数的3倍。下列说法正确的是( )
![]()
A.Y和Z的最高正化合价相同
B.气态氢化物的热稳定性:XH3<H2Y<H2Z
C.原子半径的大小:r(W)>r(Y)>r(Z)
D.W的最高价氧化物对应水化物的酸性比Z的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再稀释到100mL。在稀释后的溶液中逐滴加入0.1mol.L-1的盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如图所示。下列说法不正确的是( )

A.在NaOH溶液中通入一定量的CO2后,溶液中溶质的组成可能是①NaOH、Na2CO3②Na2CO3③Na2CO3、NaHCO3④NaHCO3
B.B曲线说明,原溶液通入CO2后,所得溶质与盐酸反应产生CO2的最大体积是11.2L(标准状况)
C.原NaOH溶液的物质的量浓度为0.15mol/L
D.B曲线表明,原溶液通入CO2后,所得溶液中溶质的化学式为NaOH、Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·7H2O)可作人体补血剂。某同学欲测定补血剂中铁元素的含量,设计了如下实验步骤:

请回答下列问题:
(1)步骤②加入过量H2O2的目的是__。
(2)步骤③加入了足量氨水,反应的离子方程式为__。
(3)步骤④中一系列处理的操作步骤:过滤、__、干燥、灼烧、冷却、称量。
(4)若实验中铁无损耗,则每片补血剂中含铁元素的质量为__g。
(5)另一位同学认为用酸性KMnO4溶液滴定也能进行铁元素含量的测定,①写出酸性KMnO4溶液与Fe2+反应的离子方程式___。
②实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、药匙、玻璃棒、量筒、烧杯、胶头滴管外,还需__。
③上述实验中的KMnO4溶液需要进行酸化处理,可用于酸化的酸的化学式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 碳酸的电离:H2CO3![]() 2H++CO32-
2H++CO32-
B. 将金属钠加入水中:2Na+2H2O===2Na++2OH-+H2↑
C. 硫化钠水解:S2-+2H2O![]() H2S↑+2OH-
H2S↑+2OH-
D. 向氯化铝溶液中加入过量的烧碱溶液:Al3++3OH-===Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列浓度关系正确的是
A.0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L的Ba(OH)2溶液至沉淀刚好完全:c (NH4+)>c (OH-)>c (SO42-)>c (H+)
B.0.1 mol/L的KOH溶液中通入标准状况下的CO2气体3.36 L,所得溶液中:c (K+)+c (H+)=c (CO32-)+c (HCO3-)+c (OH-)
C.0.1 mol/L的NaOH溶液与0.2 mol/L的HCN溶液等体积混合,所得溶液呈碱性:c (HCN)>c (Na+)>c (CN-)>c (OH-)>c (H+)
D.pH相同的NaOH溶液、CH3COONa溶液、Na2CO3溶液、NaHCO3溶液的浓度:c (NaOH)<c (CH3COONa)<c (NaHCO3)<c (Na2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:
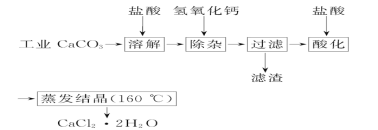
(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+。检验Fe(OH)3 是否沉淀完全的试验操作是_________________。
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③________________________。
(3)测定样品中Cl-含量的方法是:a.称取0.750 0 g样品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用0.050 00 mol· L-1 AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
①上述测定过程中需要溶液润洗的仪器有_______________________________。
②计算上述样品中CaCl2·2H2O的质量分数为________________。
③若用上述办法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因是________________________;______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能。图乙为电解氯化铜溶液的实验装置的一部分。下列说法中不正确的是
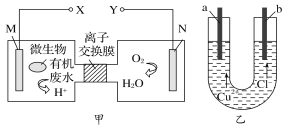
A. a极应与X连接
B. N电极发生还原反应,当N电极消耗11.2 L(标准状况下) O2时,则a电极增重64 g
C. 不论b为何种电极材料,b极的电极反应式一定为2Cl--2e-=Cl2↑
D. 若废水中含有乙醛,则M极的电极反应为:CH3CHO+3H2O-10e-=2CO2↑+10H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com