
【题目】下列离子方程式正确的是
A. 碳酸的电离:H2CO3![]() 2H++CO32-
2H++CO32-
B. 将金属钠加入水中:2Na+2H2O===2Na++2OH-+H2↑
C. 硫化钠水解:S2-+2H2O![]() H2S↑+2OH-
H2S↑+2OH-
D. 向氯化铝溶液中加入过量的烧碱溶液:Al3++3OH-===Al(OH)3↓
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2在密闭容器反应,达到平衡状态的标志是()
2NO+O2在密闭容器反应,达到平衡状态的标志是()
(1)单位时间内生成n mol O2的同时生成2n mol NO2
(2)单位时间内生成n mol O2的同时生成2n mol NO
(3)用NO2、NO、O2的物质的量浓度变化表示反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
(5)混合气体的平均相对分子质量不再改变的状态.
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】传统接触法制取硫酸能耗大,污染严将燃料电池引人硫酸生产工艺可有效解决能耗和环境污染问题,同时提供电能。以燃料电池为电源电解硫酸铜溶液的工作原理示意图如下所示。
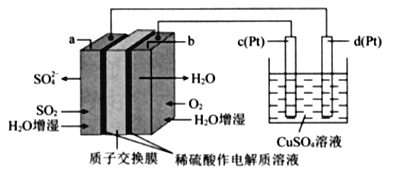
下列说法不正确的是( )
A. b极为正极,电极反应式为O2+4H++4e-=2H20
B. H+由a极通过质子交换膜向b极移动
C. 该燃料电池的总反应式为2SO2+O2+2H2O=2H2SO4
D. 若a极消耗2.24 L(标准状况)SO2,理论上c极,有6.4g铜析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是一种银白色金属,化学性质稳定,在化合物中常见+2、+3 和+6 价等价态。工业上以铬铁矿(主要成分为FeO·Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产金属铬和重铬酸钠Na2Cr2O7·2H2O(已知 Na2Cr2O7 是一种强氧化剂),其主要工艺流程如下:

查阅资料得知:常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-
回答下列问题:
(1)工业上常采用热还原法制备金属铬,写出以Cr2O3为原料,利用铝热反应制取金属铬的化学方程式_______________。
(2)酸化滤液D时,不选用盐酸的原因是_____________。
(3)固体E的主要成分是Na2SO4,根据如图分析操作a为________________、____________、洗涤、干燥。
(4)已知含+6 价铬的污水会污染环境,电镀厂产生的镀铜废水中往往含有一定量的Cr2O72-。
![]()
①Cr(OH)3的化学性质与 Al(OH)3相似。在上述生产过程中加入NaOH 溶液时要控制溶液的pH不能过高,是因为__________________________(用离子方程式表示);
②下列溶液中可以代替上述流程中Na2S2O3溶液最佳的是___________(填选项序号);
A.FeSO4溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.Na2SO3溶液
③上述流程中,每消耗0.1 mol Na2S2O3 转移0.8 mole-,则加入Na2S2O3溶液时发生反应的离子方程式为__________________________________。
(5)某厂废水中含1.00×103 mol/L的Cr2O72-,某研究性学习小组为了变废为宝,将废水处理得到磁性材料 Cr0.5Fe1.5FeO4(Cr 的化合价为+3,Fe的化合价依次为+3、+2)。欲使1L该废水中的 Cr2O72-完全转化为Cr0.5Fe1.5FeO4。理论上需要加入________gFeSO47H2O。
(已知FeSO47H2O摩尔质量为278g/mol)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)甲基的电子式___________。
(2)有下列六组物质:属于同系物的是______,属于同分异构体是______,属于同种物质的是______。(填序号)
A. 与
与 B.
B.![]() 与
与![]()
C.![]() 与
与![]() D.
D.![]() 与
与![]()
E.ClC(CH3)3与(CH3)2CHCH2Cl F.![]() 与CH3﹣CH2Cl.
与CH3﹣CH2Cl.
(3)写出由甲苯制备TNT的化学反应方程式___________。
(4)相对分子质量为72且只有一种一氯代物的烷烃的结构简式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关沉淀溶解平衡的说法中,正确的是( )
A.在AgCl的沉淀溶解平衡体系中,加入蒸馏水,Ksp(AgCl)增大
B.在CaCO3的沉淀溶解平衡体系中,加入稀盐酸,平衡不移动
C.可直接根据Ksp的数值大小比较难溶物在水中的溶解度大小
D.25 ℃时,Ksp(AgCl)>Ksp(AgI),向AgCl的悬浊液中加入KI固体,有黄色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,1 mol/L的NH4Cl、CH3COONH4、NH4HSO4三种溶液中,测得c(NH4+)分别为a、b、c(单位为 mol/L),下列判断正确的是
A. a=b=c B. a>b>c C. a>c>b D. c>a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷元素广泛存在于自然界,砷与其化合物被运用在农药、除草剂、杀虫剂等。
(1)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据图1写出As2O5分解为As2O3的热化学方程式_________________。


(2)砷酸钠具有氧化性,298 K时,在100 mL烧杯中加入10 mL 0.1 mol/L Na3AsO4溶液、20 mL 0.1 mol/L KI溶液和20 mL 0.05 mol/L硫酸溶液,发生下列反应:AsO43-(无色)+2I-+2H+![]() AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
①下列情况表明上述可逆反应达到平衡状态的是_______(填字母代号)。
a.溶液颜色保持不再变化 b.c(AsO33-)+c(AsO43-)不再变化
c.AsO43-的生成速率等于I2的生成速率 d.  保持不再变化
保持不再变化
②0~10 min内,I的反应速率v(I)=_______。
③在该条件下,上述反应的平衡常数K=______。
④升高温度,溶液中AsO43-的平衡转化率减小,则该反应的 ΔH______0(填“大于”“小于”或“等于”)。
(3)利用(2)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样0.2000 g溶于NaOH溶液,得到含AsO33-和AsO43-的混合溶液。
②上述混合液用0.02500 molL-1的I2溶液滴定,用____ 做指示剂进行滴定。重复滴定2次,平均消耗I2溶液40.00 mL。则试样中As2O5的质量分数是______。
(4)雄黄(As4S4)在空气中加热至300℃时会生成两种氧化物,其中一种氧化物为剧毒的砒霜(As2O3),另一种氧化物为______(填化学式),可用双氧水将As2O3氧化为H3AsO4而除去,写出该反应的化学方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲配制1.00mol·L-1的NaCl溶液80mL。下列说法正确的是( )
A.选用100mL容量瓶,并用蒸馏水洗净后烘干
B.用托盘天平称取5.85gNaCl固体倒入烧杯中溶解
C.定容时俯视刻度线会导致所配溶液浓度偏高
D.摇匀、静置后发现凹液面低于刻度线1~2mm,用胶头滴管加水至刻度线相平即可
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com