
【题目】实验室欲配制1.00mol·L-1的NaCl溶液80mL。下列说法正确的是( )
A.选用100mL容量瓶,并用蒸馏水洗净后烘干
B.用托盘天平称取5.85gNaCl固体倒入烧杯中溶解
C.定容时俯视刻度线会导致所配溶液浓度偏高
D.摇匀、静置后发现凹液面低于刻度线1~2mm,用胶头滴管加水至刻度线相平即可
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 碳酸的电离:H2CO3![]() 2H++CO32-
2H++CO32-
B. 将金属钠加入水中:2Na+2H2O===2Na++2OH-+H2↑
C. 硫化钠水解:S2-+2H2O![]() H2S↑+2OH-
H2S↑+2OH-
D. 向氯化铝溶液中加入过量的烧碱溶液:Al3++3OH-===Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写不正确的是
A.用两块铜片作电极电解盐酸:Cu + 2H+ ![]() H2↑ + Cu2+
H2↑ + Cu2+
B.NaOH溶液与足量的Ca(HCO3)2溶液反应:2HCO3- + 2OH- + Ca2+==CaCO3↓+ 2H2O
C.等物质的量的FeBr2和Cl2在溶液中的反应:2Fe2+ + 2Br - + 2Cl2==2Fe3+ + Br2 + 4Cl -
D.氨水吸收少量的二氧化硫:2NH3·H2O + SO2==2NH4+ +SO32- + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是聚合反应生产胶黏剂基料的单体,亦可作为合成调香剂I、聚酯材料J的原料,相关合成路线如下:

已知:在质谱图中烃A的最大质荷比为118,其苯环上的一氯代物共三种,核磁共振氢谱显
示峰面积比为3:2:2:2:1。
根据以上信息回答下列问题:
(1)A的官能团名称为__________________,B→C的反应条件为_____________,E→F的反应类型为_____________。
(2)I的结构简式为____________________,若K分子中含有三个六元环状结构,则其分子式为________________。
(3)D与新制氢氧化铜悬浊液反应的离子方程式为_______________________________。
(4)H的同分异构体W能与浓溴水反应产生白色沉淀,1 mol W参与反应最多消耗3 mol Br2,请写出所有符合条件的W的结构简式___________________________________。
(5)J是一种高分子化合物,则由C生成J的化学方程式为
______________________________________________________________________。
(6)![]() 已知:
已知:![]() (R为烃基)
(R为烃基)
设计以苯和乙烯为起始原料制备H的合成路线(无机试剂任选)。
[合成路线示例:]![]()
_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能。图乙为电解氯化铜溶液的实验装置的一部分。下列说法中不正确的是
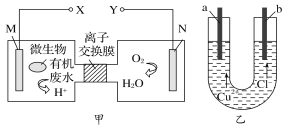
A. a极应与X连接
B. N电极发生还原反应,当N电极消耗11.2 L(标准状况下) O2时,则a电极增重64 g
C. 不论b为何种电极材料,b极的电极反应式一定为2Cl--2e-=Cl2↑
D. 若废水中含有乙醛,则M极的电极反应为:CH3CHO+3H2O-10e-=2CO2↑+10H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用18mol·L-1的浓硫酸配制100mL3.0mol·L-1稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积②量取一定体积的浓硫酸③溶解
④检漏、转移、洗涤⑤定容、摇匀
回答下列问题:
(1)所需浓硫酸的体积是__(保留一位小数),量取浓硫酸所用的量筒的规格是__(用下列编号填空)。
A.10mL B.25mL C.50mL D.100mL
(2)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”“偏小”或“无影响”填写)
①容量瓶用蒸馏水洗涤后残留有少量的水__。
②转移完溶液的烧杯、玻璃棒未洗涤__。
③加水超过刻度线后,用胶头滴管吸出多余的液体__。
(3)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84g·cm-3)的浓硫酸配制2000mL2.3mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为__mol·L-1。
②需用浓硫酸的体积为__mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属锰及其化合物在工农业生产和科研领域具有广泛的应用。
Ⅰ.溶液中的Mn2+可被酸性(NH4)2S2O8溶液氧化为 MnO4-,该方法可用于检验Mn2+。
(1)用酸性(NH4)2S2O8溶液检验Mn2+时的实验现象为________。
(2)该反应的离子方程式为________。
(3)(NH4)2S2O8可视为由两分子硫酸缩合所得,则H2S2O8的结构式为 ________。
Ⅱ.实验室用含锰废料(主要成分为MnO2,还含有少量Al2O3、MgO、SiO2)为原料制备Mn的工艺流程如下图所示。

难溶物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 | Mn(OH)2 |
溶度积常数 | 4.0×10-38 | 1.0×10-33 | 1.8×10-11 | 1.8×10-13 |
(4)“酸浸”时,MnO2将Fe氧化为Fe3+,该反应的离子方程式为___________;该过程中浸出时间和液固比对锰浸出率的影响分别如下图所示。

则适宜的浸出时间和液固比分别为____________、____________。
(5)若“酸浸”后所得滤液中c(Mn2+)=0.18molL-1,则应“调pH”的范围为_________。
(6)“煅烧”反应中氧化剂与还原剂的物质的量之比为________。“还原”时发生的置换反应在化学上又叫作__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将100 mL稀硝酸和稀硫酸的混合酸溶液平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g(假设此时硝酸只被还原为NO,下同);向另一份中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示。则下列判断中错误的是

A.OA段产生的气体是NO,BC段产生的气体是H2
B.A点对应消耗NO3-物质的量为0.1 mol
C.B点对应消耗铁粉的质量为8.4 g
D.原混合酸溶液中H2SO4的浓度为2.0 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑(Sb)及其化合物在工业上有许多用途。以辉锑矿(主要成分为Sb2S3,还含有PbS、As2S3、CuO、SiO2等)为原料制备金属锑的工艺流程如图所示:

已知:①浸出液中除含过量盐酸和SbCl5之外,还含有SbCl3、PbCl2、AsCl3、CuCl2等;
②常温下:Ksp(CuS)=1.27×10-36,Ksp(PbS)=9.04×10-29;
③溶液中离子浓度≤1.0×10-5mol·L-1时,认为该离子沉淀完全。
(1)滤渣1中除了S之外,还有________ (填化学式)。
(2)“浸出”时,Sb2S3发生反应的化学方程式为___________________________________。
(3)“还原”时,被Sb还原的物质为________(填化学式)。
(4)常温下,“除铜、铅”时,Cu2+和Pb2+均沉淀完全,此时溶液中的c(S2-)不低于_____;所加Na2S也不宜过多,其原因为_________________________________。
(5)“除砷”时有H3PO3生成,该反应的化学方程式为________________________________。
(6)“电解”时,被氧化的Sb元素与被还原的Sb元素的质量之比为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com