
����Ŀ������������������Ҫ��ҽҩ�м��壬��A��BΪԭ�Ϻϳɱ�����������F·������:

(1) A�ķ���ʽΪC2H2O3���ɷ���������Ӧ���Ҿ������ԣ�A��������������Ϊ��__________��д��A+B��C�Ļ�ѧ��Ӧ����ʽΪ_______________��
(2) C��3����OH��������ǿ������˳���ǣ�_____________��
C��3����OH��������ǿ������˳���ǣ�_____________��
(3)E����2����C���ɵĺ���3����Ԫ���Ļ����E�ķ����в�ͬ��ѧ��������ԭ����________�֡�
(4)D��F�ķ�Ӧ������_________, 1 mol F��һ��������������NaOH��Һ��Ӧ���������NaOH�����ʵ���Ϊ______________mol��д����������������F������ͬ���칹�壨�����������칹���Ľṹ��ʽ:____________________��
������һԪ�������ڱ�����ֻ��2��ȡ�����Ҵ��ڶ�λ������һ�����ǻ�
(5)��֪: ![]()
A�ж��ֺϳɷ������ڷ�����д��������ϳ�A��·������ͼ������ԭ����ѡ���ϳ�·������ͼʾ�����£�![]() _________________________________________
_________________________________________
���𰸡� ȩ�����Ȼ�  �� > �� > �� 4 ȡ����Ӧ 3
�� > �� > �� 4 ȡ����Ӧ 3 
![]()
��������������Ҫ�����л���Ľṹ�����ʡ�
(1) A�ķ���ʽΪC2H2O3���ɷ���������Ӧ���Ҿ������ԣ�A��������������Ϊ��ȩ�����Ȼ���A+B��C�Ļ�ѧ��Ӧ����ʽΪ ��
��
(2)  C��3����OH��������ǿ������˳���ǣ��� > �� > �ڡ�
C��3����OH��������ǿ������˳���ǣ��� > �� > �ڡ�
(3)E����2����C���ɵĺ���3����Ԫ���Ļ����E�ķ����в�ͬ��ѧ��������ԭ����4�֡�
(4) D��F�ķ�Ӧ������ȡ����Ӧ, 1 mol F��һ��������������NaOH��Һ��Ӧ���������NaOH�����ʵ���Ϊ3mol����������������F������ͬ���칹�壨�����������칹���Ľṹ��ʽ:  ��
��
(5)![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A������������һ����CH2ԭ���ŵ��л�����ͬϵ��
B�������Ԫ������������ͬ������ͬһ����
C������ʽ��ͬ���ṹʽ��ͬ���л���һ����Ϊͬ���칹��
D����Է���������ͬ���л���һ����Ϊͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʻ����ʵ���Ҫ�ɷֶ�Ӧ��ѧʽ�������
A. ͭ�̣�Cu2(OH)2CO3 B. â����NaNO3��10H2O
C. Ư�۾���Ca(ClO)2 D. ˮ������Na2SiO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У���ԭ���Ͽ�����Ƴ�ԭ��ص��ǣ� ��
A. Ba(OH)2��8H2O��NH4Cl�ķ�Ӧ B. ������������ķ�Ӧ
C. �����������ķ�Ӧ D. ʯ��ʯ�ķֽⷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
������̫���ܵ���е�����̫���ܵ�ء��ྦྷ��̫���ܵ�ء�GaAs̫���ܵ�ؼ�ͭ��������Ĥ̫���ܵ�صȡ�
��1��Cu+�ڻ�̬ʱ�ļ۵����Ų�ʽΪ______��
��2���顢���ǵ������ڵ�����Ԫ�أ���֪��ĵ�һ�����ܴ����������ԭ�ӽṹ�ĽǶȼ��Խ���______��
��3��GaAs�۵�1238�棬�������ܼ����侧������Ϊ_________��
��4��AsF3�Ŀռ乹���ǣ�______________��
��5�����ᣨH3BO3���������ܵ����H+����ˮ�����һ��OH-����[B(OH)4]-�������������ԡ�
��[B(OH)4]-��Bԭ�ӵ��ӻ�����Ϊ______��
��[B(OH)4]-�ĽṹʽΪ____________��
��6�����ʯ�ľ�������ͼ�����Թ�ԭ�Ӵ�����ʯ�����е�̼ԭ�ӣ���õ�����裺�������ʯ������һ���̼ԭ�ӓQ�ɹ�ԭ�ӣ���̼����ԭ�ӽ��棬���õ�̼���辧�壨���ɰ����
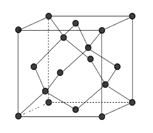
�ٽ��ʯ������衢̼������۵��ɸߵ��͵�����˳����_______(�û�ѧʽ��ʾ)��
��������������Ľṹ����ʯ���ƣ�Ӳ������ʯ�൱�������߳�Ϊ361.5pm��������������ܶ���___________g���M-3(B�����ԭ������Ϊ11��ֻҪ������ʽ�����ؼ������ֵ������٤������ΪNA)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������60��������ϣ�����ͷ����������������ӻԻ�׳�ۣ���Щ����ͷ������ijЩԪ�ص���ɫ��Ӧ�йء�����˵����������
A���۲�K2CO3����ɫӦ����ɫ�IJ��� B����ɫ��Ӧʵ���г���ϡ����ϴ�ӽ���˿
C����������ɫ��Ӧ������NaCl��KCl D��Na��Na2SO4������ʱ������ɫ��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧС���������������������װ�ã���ͼ1)���Ի������Ʊ�����ϩ
��֪: 

�ܶ�(g/cm3) | �۵㣨�棩 | �е㣨�棩 | �ܽ��� | |
���Ҵ� | 0.96 | 25 | 161 | ������ˮ |
����ϩ | 0.81 | -103 | 83 | ������ˮ |
(1) �Ʊ���Ʒ��12.5 mL�����������Թ�A�У��ټ���lmLŨ���ᣬҡ�Ⱥ�������Ƭ������������Ӧ��ȫ�����Թ�C�ڵõ�����ϩ��Ʒ��
��A�����Ƭ��������____________������B���˵�������е�������____________���Թ�C���ڱ�ˮԡ�е�Ŀ����______________________��
(2)�Ʊ���Ʒ
�ٻ���ϩ��Ʒ�к��л������������������ʵȡ����뱥��ʳ��ˮ�������á��ֲ㣬����ϩ��______�㣨���ϻ��£�����Һ����___________(�����ţ�ϴ�ӡ�
a. KMnO4��Һ b.ϡ H2SO4 c. Na2CO3��Һ
���ٽ�����ϩ��ͼ2��ʾװ��������ȴˮ��________�ڽ��룬�ռ���Ʒʱ�����Ƶ��¶�Ӧ��______���ҡ�
(3)�������ֻ���ϩ��Ʒ����Ʒ�ķ�������������_____________��
a.�����Ը��������Һ b.��NaOH��Һ c.�ⶨ�е�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦCO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g) ��H<0,�ﵽƽ��ʱ������˵����ȷ����
CO(NH2)2(s)+H2O(g) ��H<0,�ﵽƽ��ʱ������˵����ȷ����
A. ���������ƽ�ⳣ������
B. ��С�������������Ӧ���������淴Ӧ���ʼ�С
C. ����CO(NH2)2����, CO2��ת���ʼ�С
D. �����¶ȣ�ƽ�����淴Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ӷ��Է����������о��Ǹ�������ѧѧϰ����Ҫ��չ���̡����������ѧ֪ʶ�����»�ѧ������ж���������
��1�����������һ�ֵ��͵�ǿ������������KMnO4������Һ����CuS�Ļ����ʱ�������ķ�Ӧ���£�6 MnO4��+5 CuS + 28H+ = 5Cu2+ + 5SO2�� +6 Mn2+�� 14H2O�����õ����ŷ�����÷�Ӧ�е���ת�Ƶķ������Ŀ��
6 MnO4��+5 CuS + 28H+ = 5Cu2+ + 5SO2�� +6 Mn2+�� 14H2O ________________
��2������������ײʱ����ȫ�����з�����Ӧ10NaN3��2KNO3=K2O��5Na2O��16N2��������������Ȼ�ԭ�����1.75 mol�� ��ת�Ƶĵ�����Ϊ__________�� ��������Nԭ�ӵ����ʵ���Ϊ__________��
��3��ʵ������ҪΪ������������1 L�ں�0.24 mol K2SO4��0.5 mol NH4Cl��0.16 mol KCl��ijӪ��Һ��ijС��ƻ���(NH4)2SO4��KCl��NH4Cl���ƣ����������ֹ�������ʵ����ֱ�Ϊ_________��_________��_________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com