
【题目】有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20,其中C、E是金属元素;A和E属同一族,且A为非金属元素,它们原子的最外层电子排布为ns1,B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍。C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)A是________,B是________,E是________(写元素符号)。
(2)写出C元素基态原子的电子排布式__________________________________。
(3)用轨道表示式表示D元素原子的价电子排布__________________________。
【答案】 H O K 1s22s22p63s23p1 
【解析】A、B、C、D、E5种短周期元素,它们的核电荷数依次增大,且都小于20,B和D属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,最外层电子排布为ns2np4,则B为O元素、D为S元素;A和E属同一族,它们原子的最外层电子排布为ns1,处于IA族,E的原子序数大于硫,且5种元素中只有C、E是金属元素,则A为H元素、E为K元素;C原子最外层上电子数等于D原子最外层上电子数的一半,其最外层电子数为6×![]() =3,故C为Al。
=3,故C为Al。
(1)由上述分析可知,A为H、B为O、C为K,故答案为:H;O;K;
(2)C为铝元素元素,原子核外有13个电子,基态原子的电子排布为1s22s22p63s23p1 或[Ne]3s23p1,故答案为:1s22s22p63s23p1 或[Ne]3s23p1;
(3)D为S元素,原子价层电子排布为3s23p4,轨道表示式为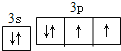 ,故答案为:
,故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】六氟化硫分子呈正八面体形(如图所示),在高电压下仍有良好的绝缘性,在电器工业方面有着广泛的用途,但逸散到空气中会引起温室效应。下列有关六氯化硫的推测正确的是

A. 六氟化硫不能燃烧
B. 六氟化硫中各原子均达到8电子稳定结构
C. 六氟化硫在水中的溶解度>六氟化硫在CS2中的溶解度
D. 六氟化硫分子是极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为短周期元素,其原子半径、化合价等信息见下表。

有关这四种元素的说法一定正确的是
A. X与W形成的化合物的电子式可表示为![]()
B. Y的氢化物能与W的氢化物反应,所得产物只含有共价键
C. X、Y能分别与氧元素形成多种氧化物
D. Z处于元素周期表中第三周期ⅣA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列推断正确的是( )
A.BF3是三角锥形分子
B.NH![]() 的电子式:
的电子式: ,离子呈平面形结构
,离子呈平面形结构
C.CH4分子中的4个C﹣H键都是氢原子的1s轨道与碳原子的p轨道形成的s﹣p σ键
D.CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个s﹣sp3σ键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在科学研究和工业生产中具有许多用途。请回答下列问题:
(1)Cu2O中阳离子的基态核外电子排布式为__________________; Cu和Ni在元素周期表中的位置相邻, Ni在周期表中的位置是__________________。
(2)将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体 [Cu( NH3)4]SO4·H2O。
①乙醇分子中C 原子的轨道杂化类型为__________________,NH3与H+以配位键形成NH4+,则NH4+的空间构型为____________________。
②[Cu( NH3)4]SO4·H2O]中存在的化学键除了极性共价键外,还有____________________。
③NH3极易溶于水的原因主要有两个,一是_______________,二是_______________________。
(3)CuSO4溶液中加入过量KCN溶液能生成配离子[Cu(CN)4]2-,1mol CN-中含有的π键数目为__________。与CN-互为等电子体的离子有____________(写出一种即可)。
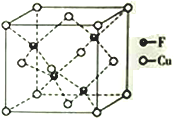
(4)Cu 与F形成的化合物的晶胞结构如图所示,若晶体密度为a g·cm-3,则Cu与F最近距离为____________pm(用NA表示阿伏加德罗常数的值,列出计算表达式,不用化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,

请参照元素A~H在表中的位置,用化学用语回答下列问题:
(1)D、E、F的原子半径由大到小的顺序为_______________________________。
(2)B、C、D的第一电离能由大到小的顺序为_____________________________。
(3)A、D、E、H中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:______________________。
(4)E、F的最高价氧化物的水化物相互反应的离子方程式:__________________。
(5)在B所形成的化合物CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有______________;与CO分子互为等电子体的分子和离子分别为________和________,根据等电子理论推测CO分子的结构式可表示成________,一个CO分子中有________个σ键,________个π键。
(6)根据价电子对互斥理论预测D和H所形成的HD的空间构型为_________形。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家制造出由4个氧原子构成的氧分子,并用质谱仪探测后证实了它的存在.若该氧分子具有空间对称结构,下列关于该氧分子的说法正确的是( )
A.是氧元素的一种同位素
B.是氧气的同素异形体,分子内含有共价键
C.是一种新的氧化物
D.是臭氧的同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质硫化亚铁。这现象说明了
A. 该反应是吸热反应
B. 该反应是放热反应
C. 铁粉和硫粉在常温下可以发生反应
D. 硫化亚铁的总能量高于铁粉和硫粉的总能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com